- Salpetrige Säure
-
Strukturformel 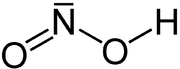
Allgemeines Name Salpetrige Säure Andere Namen - Hydrogennitrit
- Stickstoff(III)-säure
Summenformel HNO2 CAS-Nummer 7782-77-6 Eigenschaften Molare Masse 47,01 g·mol−1 Aggregatzustand nur in kalter wässriger Lösung beständig[1]
pKs-Wert 3,29 [2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Salpetrige Säure (nach der Nomenklatur der IUPAC Hydrogennitrit genannt) ist eine nur in kalter und verdünnter wässriger Lösung beständige, mittelstarke Säure.
Inhaltsverzeichnis
Synthese
Stickstoffdioxid NO2 disproportioniert beim Einleiten in Wasser, z. B. im Rahmen des Ostwald-Verfahrens, in Salpetersäure und Salpetrige Säure:
Daher kann NO2 formal als gemischtes Anhydrid von HNO2 und HNO3 betrachtet werden. In ähnlicher Weise lassen sich die Salze der Salpetrigen Säure, die Nitrite mit dem Anion NO2-, durch Disproportionierung von Stickstoffmonoxid NO in konzentrierten Laugen bei hohen Temperaturen herstellen[2]:
Als Zwischenprodukt entsteht hierbei Hyponitrit N2O22-, das bei den Reaktionsbedingungen instabil ist und unter Freisetzung von Distickstoffmonoxid zerfällt.
Reaktionsverhalten
Salpetrige Säure zerfällt bei Erwärmung in einer Disproportionierungsreaktion zu Salpetersäure und Stickstoffmonoxid:
Versetzt man Salpetrige Säure mit alkalischen Lösungen, bilden sich die stabileren Nitrite. Beispielsweise entsteht bei der Reaktion von Salpetriger Säure mit verdünnter Natronlauge Natriumnitrit:
Da das Stickstoff-Atom in der Salpetrigen Säure die Oxidationsstufe +III besitzt, kann Salpetrige Säure durch starke Oxidationsmittel zu Salpetersäure oxidiert werden (Oxidationsstufe +V). So gelingt eine Oxidation der salpetrigen Säure mit schwefelsaurer Kaliumpermanganat-Lösung:
Nachweis
Eine einfache, aber nicht spezifische Nachweismethode ist die Oxidation von Iodid zu Iod durch Salpetrige Säure. Man bedient sich hierbei der Iod-Stärke-Reaktion, die schon sehr geringe Konzentrationen (wenige ppm) Salpetriger Säure durch den entstandenen Polyiodid-Stärke-Komplex mittels Blaufärbung anzeigt. Hierzu wird das sogenannte Kaliumiodidstärkepapier benutzt.
Spezifisch können Salpetrige Säure bzw. Nitrite mit Lunges Reagenz nachgewiesen werden, wobei sich ein roter Azofarbstoff bildet.
Toxizität
Salpetrige Säure ist ein Mutagen und hat eine negative Wirkung auf Organismen. Die Säure kann Cytosin in Uracil umwandeln. Uracil paart aber im Gegensatz zu Cytosin mit Adenin, weswegen sich das Basenpaar C-G nach zwei Replikationen zu T-A umwandelt (eine Punktmutation). Da Uracil jedoch in der DNA nicht vorkommt, werden solche Fehler relativ leicht erkannt und korrigiert.
Siehe auch
- Salpetersäure HNO3 (Hydrogennitrat)
Einzelnachweise
- ↑ Helmut Sitzmann, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Holleman-Wiberg, Lehrbuch der Anorganischen Chemie, 101. Auflage, de Gruyter Verlag, 1995, ISBN 3-11-012641-9.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Wikimedia Foundation.






