- NpO2
-
Kristallstruktur 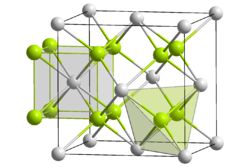
Np4+: __ O2-: __ Kristallsystem kubisch Raumgruppe 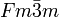
Koordinationszahlen Np[8], O[4] Allgemeines Name Neptunium(IV)-oxid Andere Namen Neptuniumdioxid
Verhältnisformel NpO2 CAS-Nummer 12035-79-9 Kurzbeschreibung braungrüner kristalliner Feststoff Eigenschaften Molare Masse 269,047 g·mol−1[1] Aggregatzustand fest
Dichte 11,100 g·cm−3[1]
Schmelzpunkt 2600 °C[2]
Löslichkeit unlöslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Neptunium(IV)-oxid oder auch Neptuniumdioxid ist das chemisch stabilste Oxid des Neptuniums. Es ist ein kristalliner braun-grüner Feststoff mit einem hohen Schmelzpunkt von 2600 °C.
Inhaltsverzeichnis
Eigenschaften
Neptuniumdioxid ist wenig reaktiv und wird von Wasser fast nicht angegriffen. Neptuniumdioxid weist ein kubisches Kristallsystem auf, hat die Raumgruppe
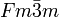 , der Strukturtyp ist der CaF2-Typ (Fluorit) und die Koordinationszahlen sind Np[8], O[4].
, der Strukturtyp ist der CaF2-Typ (Fluorit) und die Koordinationszahlen sind Np[8], O[4].Gewinnung und Darstellung
Neptuniumdioxid entsteht durch die Oxidation von Neptuniummetall in einer oxidierenden Atmosphäre bei Normaltemperatur und -druck. Es wurde 1944 als erste Verbindung des damals neuen Elements hergestellt.[4]
Verwendung
Bei der Wiederaufbereitung von Kernbrennstäben fällt Neptuniumdioxid als Zwischenprodukt an. Als chemisch stabilste Form des Neptuniums findet es selbst wiederum Verwendung in Kernbrennstäben. Dazu wird es (vor allem das Isotop 237Np zusammen mit unwesentlichen Mengen anderer Neptuniumisotope) vom abgebrannten Reaktorbrennstoff abgetrennt und in Brennstäbe gefüllt, die nur Neptuniumdioxid enthalten. Diese werden wieder in den Kernreaktor eingesetzt, wo sie erneut mit Neutronen bestrahlt werden; aus dem 237Np wird 238Pu erbrütet.
Die Darstellung des Neptunium(IV)-chlorids gelingt durch Reaktion von Neptuniumdioxid mit Tetrachlormethan bei höheren Temperaturen.
Einzelnachweise
- ↑ a b Neptunium(IV)-oxid bei www.webelements.com.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1972.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ C&EN: It's Elemental: The Periodic Table – Neptunium (engl.)
Wikimedia Foundation.
