- Tetrachlormethan
-
Strukturformel 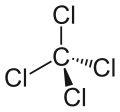
Allgemeines Name Tetrachlormethan Andere Namen - Tetrachlorkohlenstoff
- Kohlenstofftetrachlorid
- Tetra
- R-10
Summenformel CCl4 CAS-Nummer 56-23-5 PubChem 5943 Kurzbeschreibung farblose, süßlich riechende Flüssigkeit[1]
Eigenschaften Molare Masse 153,82 g·mol−1 Aggregatzustand flüssig
Dichte 1,58 g·cm−3[1]
Schmelzpunkt Siedepunkt 76,7 °C[1]
Dampfdruck Löslichkeit sehr schlecht in Wasser (0,8 g·l−1 bei 20 °C)[1]
Brechungsindex 1,4630[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Gefahr
H- und P-Sätze H: 351-331-311-301-372-412 EUH: 059 P: 273-281-314-501 [4] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23/24/25-40-48/23-52/53-59 S: (1/2)-23-36/37-45-59-61 MAK 0,5 ml·m−3[1]
LD50 2350 mg·kg−1 (Ratte, oral)[5]
GWP 1400 (bezogen auf 100 Jahre)[6]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Tetrachlormethan (auch Tetrachlorkohlenstoff, Tetra) ist eine chemische Verbindung aus der Reihe der Chlorkohlenwasserstoffe. Bei ihm sind alle Wasserstoffatome des Methans durch Chloratome substituiert. Beide Bezeichnungen sind nach der IUPAC-Nomenklatur korrekt, abhängig davon, ob die Verbindung als organische (Tetrachlormethan) oder anorganische (Tetrachlorkohlenstoff) Verbindung angesehen wird.
Inhaltsverzeichnis
Herstellung
Tetrachlormethan fällt bei der industriellen Herstellung von Chloroform an. Dazu wird Chlor mit Methan oder Chlormethan auf 400–500 °C erhitzt. Bei dieser Temperatur findet eine schrittweise radikalische Substitution bis hin zu Tetrachlormethan statt:
- Methan reagiert mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, und weiter zu Dichlormethan, Trichlormethan (Chloroform) und schließlich Tetrachlormethan.
Das Ergebnis des Prozesses ist eine Mischung der vier Chlormethane, welche durch Destillation getrennt werden können.
Eigenschaften
Physikalische Eigenschaften
Tetrachlormethan ist eine farblose, stark lichtbrechende, süßlich riechende, nicht brennbare, giftige Flüssigkeit mit einem Schmelzpunkt von −23 °C und einem Siedepunkt von 76,7 °C. Tetrachlormethan ist mit Wasser nicht mischbar, mit Ethanol, Ether oder Benzin ist es gut mischbar und es löst Fette, Öle und Harze.
Chemische Eigenschaften
Tetrachlormethan ist sehr reaktionsträge und wird von Säuren und Laugen nicht angegriffen. Bei Kontakt mit Alkalimetallen und Aluminium findet jedoch eine explosionsartige Reaktion statt. Unter Licht- und Wärmeeinwirkung entsteht besonders in Anwesenheit von Feuchtigkeit das Giftgas Phosgen. Tetrachlormethan gehört zu den krebserzeugenden Stoffen und ist wie Chloroform stark leberschädigend. Außerdem ist es schädlich für Wasserorganismen und trägt mit zum Abbau der Ozonschicht bei, da es sich unter UV-Einwirkung aufspaltet: Es entstehen Chlorradikale, die sehr schädlich auf Ozon wirken (Ozonloch in der Arktis und Antarktis).
Verwendung
Tetrachlormethan wurde in frühen Generationen von Feuerlöschern verwendet. Heutzutage wird es jedoch aufgrund der großen Toxizität der Substanz nicht mehr für die Brandbekämpfung eingesetzt.
Aufgrund der toxischen und krebserregenden Eigenschaften und auch der Ozonschicht schädigenden Wirkung darf Tetrachlormethan nach der Chemikalien-Ozonschichtverordnung nicht mehr verwendet werden. Die Anwendung als Feuerlöschmittel sowie als Entfettungs-, Reinigungs-, Lösungs- und Verdünnungsmittel ist aufgrund seiner Toxizität und seiner ungünstigen Umwelteigenschaften nur noch zu Forschungszwecken erlaubt.
Wirkung auf den Menschen
Dämpfe von Tetrachlormethan verursachen je nach eingeatmeter Konzentration:
- Kopfschmerzen
- Übelkeit und Schwindel
- Schäden des Zentralnervensystems
- Herabsetzung der Sinnesleistungen (Sehschärfe, Gehörempfindlichkeit usw.)
Dauerhafte Exposition führt zur schweren Schädigungen der Leber und Nieren. Im Tierversuch hat sich Tetrachlormethan als krebserregend erwiesen.
Bei Hautkontakt sollte man es mit viel Wasser oder Polyethylenglykol abwaschen (letzteres hat eine gute Reinigungswirkung).
Alkohol kann die Toxizität von Tetrachlormethan beträchtlich erhöhen.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Tetrachlormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Dezember 2007 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Eintrag zu CAS-Nr. 56-23-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Carbon tetrachloride bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Tetrachlormethan bei ChemIDplus.
- ↑ P. Forster, P., V. Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing, in: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 212; PDF.
Weblinks
 Commons: Tetrachlormethan – Sammlung von Bildern, Videos und AudiodateienTetrahalogenmethane
Commons: Tetrachlormethan – Sammlung von Bildern, Videos und AudiodateienTetrahalogenmethaneTetrafluormethan | Tetrachlormethan | Tetrabrommethan | Tetraiodmethan
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Tetrachlormethan — Tetrachlormethan, s. Kohlenstoffchloride … Meyers Großes Konversations-Lexikon
Tetrachlormethan — ◆ Te|tra|chlor|me|than 〈[ klo:r ] n. 11〉 = Tetrachlorkohlenstoff ◆ Die Buchstabenfolge te|tr... kann in Fremdwörtern auch tet|r... getrennt werden. * * * Tẹ|t|ra|chlor|me|than; Syn.: Tetrachlorkohlenstoff, (Jargon:) Tetra: CCl4; farblose,… … Universal-Lexikon
Tetrachlormethan — ◆ Te|tra|chlor|me|than 〈[ klo:r ] n.; Gen.: s; Pl.: unz.; Chemie〉 = Tetrachlorkohlenstoff ◆ Die Buchstabenfolge te|tr… kann auch tet|r… getrennt werden … Lexikalische Deutsches Wörterbuch
Carbontetrachlorid — Strukturformel Allgemeines Name Tetrachlormethan Andere Namen Tetrachlorkohlenstoff Kohlenstofftetrachlorid T … Deutsch Wikipedia
Kohlenstofftetrachlorid — Strukturformel Allgemeines Name Tetrachlormethan Andere Namen Tetrachlorkohlenstoff Kohlenstofftetrachlorid T … Deutsch Wikipedia
Tetrachlorkohlenstoff — Strukturformel Allgemeines Name Tetrachlormethan Andere Namen Tetrachlorkohlenstoff Kohlenstofftetrachlorid … Deutsch Wikipedia
Alkylchlorid — Struktur der verschiedenen Klassen monohalogenierter Kohlenwasserstoffe: I=Halogenalkan (Halogenpropan), II=Halogenalken (Halogenpropen), III=Halogenaromat (Halogenbenzol); X=Fluor, Chlor, Brom oder Iod Als Halogenkohlenwasserstoffe oder… … Deutsch Wikipedia
Alkylchloride — Struktur der verschiedenen Klassen monohalogenierter Kohlenwasserstoffe: I=Halogenalkan (Halogenpropan), II=Halogenalken (Halogenpropen), III=Halogenaromat (Halogenbenzol); X=Fluor, Chlor, Brom oder Iod Als Halogenkohlenwasserstoffe oder… … Deutsch Wikipedia
Alkylhalogenid — Struktur der verschiedenen Klassen monohalogenierter Kohlenwasserstoffe: I=Halogenalkan (Halogenpropan), II=Halogenalken (Halogenpropen), III=Halogenaromat (Halogenbenzol); X=Fluor, Chlor, Brom oder Iod Als Halogenkohlenwasserstoffe oder… … Deutsch Wikipedia
Arylhalogenid — Struktur der verschiedenen Klassen monohalogenierter Kohlenwasserstoffe: I=Halogenalkan (Halogenpropan), II=Halogenalken (Halogenpropen), III=Halogenaromat (Halogenbenzol); X=Fluor, Chlor, Brom oder Iod Als Halogenkohlenwasserstoffe oder… … Deutsch Wikipedia




