- 3TC
-
Strukturformel 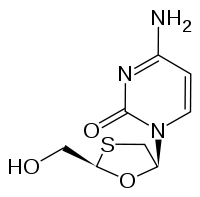
Allgemeines Freiname Lamivudin Andere Namen - (−)-2'-Desoxy-3'-thiacytidin (3TC)
- (−)-4-Amino-1-[(2S,5R)-2-(hydroxymethyl)- 1,3-oxathiolan-5-yl]pyrimidin-2-on
Summenformel C8H11N3O3S CAS-Nummer 134678-17-4 PubChem 73339 ATC-Code J05AF05
DrugBank DB00709 Kurzbeschreibung weißes bis fast weißes, polymorphes Pulver [1] Arzneistoffangaben Wirkstoffklasse Virustatikum, nukleosidische Reverse-Transkriptase-Inhibitoren
Wirkmechanismus Fertigpräparate - Epivir®
- Zeffix®
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 229,257 g·mol−1 Schmelzpunkt 160–162 °C [2]
Löslichkeit löslich in Wasser (70 mg·ml−1), [2] wenig löslich in Methanol, schwer löslich in Ethanol 96 % [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 63 S: 36/37-53 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lamivudin (Handelsnamen: Epivir®, Zeffix®; Hersteller: GlaxoSmithKline) ist ein Arzneistoff zur Behandlung von HIV-1-infizierten Patienten im Rahmen einer antiretroviralen Therapie (HAART) und der chronischen HBV-Infektion.
Es ist ein chemisches Analogon des Nukleosids Cytidin und zählt zur Gruppe der nukleosidischen Reverse-Trankriptase-Inhibitoren (NRTI).
Inhaltsverzeichnis
Geschichte
Lamivudin ist seit 1995 in Deutschland zugelassen. Nach Zidovudin (AZT) ist es derzeit das zweithäufigste gebrauchte Wirkstoff in der HIV-Therapie.
Pharmakologie
Lamivudin wird intrazellulär in ein 5'-Triphosphat umgewandelt. So verändert kann es, wie bei anderen Nukleosid-Analoga, in die virale DNA eingebaut werden und führt zum Abbruch der DNA-Synthese.[3]
Pharmakokinetik
Die Bioverfügbarkeit von Lamivudin nach oraler Gabe beträgt etwa 80 %. Die maximalen Serumkonzentrationen liegen nach üblicher Dosierung (2-mal täglich 2 mg/kg KG) bei 1,5 bis 1,9 mg/l. Bei gleichzeitiger Nahrungsaufnahme wird die Bioverfügbarkeit nicht signifikant beeinflusst. Das Verteilungsvolumen wird mit 1,3 l/kg KG angegeben. Der Arzneistoff wird mit einer Halbwertzeit von 5 bis 7 Stunden überwiegend unverändert renal eliminiert. Die Bindung an Plasmaproteine ist gering. Bei renaler Insuffizienz (Clearance < 50 ml/min) wird eine Dosis von 150 mg nur alle 24 Stunden verabreicht; falls die Nierenfunktion in höherem Maße eingeschränkt ist, soll die Einzeldosis zunächst halbiert und dann entsprechend der individuellen Situation weiter angepasst werden.[3]
Nebenwirkungen
Nebenwirkungen sind selten. Müdigkeit, Übelkeit, Erbrechen, Diarrhoe, Kopfschmerzen, Schlaflosigkeit, Muskelschmerzen sind i.d.R. auf AZT oder Abacavir zurückzuführen. Selten Polyneuropathien, sehr selten Pankreatitiden und Laktatazidosen, Anämien.[4]
Resistenzen
HI-Viren entwickeln bei Mono- oder Bitherapie relativ leicht Resistenzen gegen Lamivudin: Eine einzige Mutation im Erbgut (M184V oder M184I) genügt, um HIV gegen Lamivudin hochgradig resistent werden zu lassen. Daher muss Lamivudin zur AIDS-Therapie grundsätzlich in Kombination mit mindestens zwei anderen antiretroviralen Arzneistoffen gegeben werden.
Darreichungsformen
Lamivudin wird peroral verabreicht: etwa in Form von Tabletten zu 100 mg, 150 mg oder 300 mg oder einer Lösung zum Einnehmen. Ferner gibt es fixe Kombinationen mit AZT oder Abacavir.
Einzelnachweise
- ↑ a b c d Safety Data Sheet for LAMIVUDINE CRS – European Pharmacopoeia (Ph. Eur. 6.2) 26. Februar 2009
- ↑ a b Lamivudin bei DrugBank
- ↑ a b Lamivudin, Information der Zeitschrift für Chemotherapie, aus Heft 6, 1996.
- ↑ http://hiv.net/2010/drugs/lamivu.htm
Weblinks
- Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation zu Zeffix auf der Website der Europäischen Arzneimittelagentur (EMEA)
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
