- Pyroglutamyl
-
Strukturformel 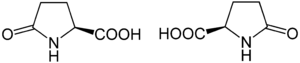
L-Pyroglutaminsäure (links) und D-Pyroglutaminsäure (rechts)Allgemeines Name Pyroglutaminsäure Andere Namen - L-Pyroglutaminsäure
- L-5-Oxoprolin
- L-5-Oxo-2-pyrrolidincarbonsäure
- (S)-Pyroglutaminsäure
- (S)-5-Oxoprolin
- (S)-5-Oxo-2-pyrrolidincarbonsäure
- D-Pyroglutaminsäure
- (R)-Pyroglutaminsäure
- (R)-5-Oxoprolin
- (R)-5-Oxo-2-pyrrolidincarbonsäure
Summenformel C5H7NO3 CAS-Nummer - 98-79-5 (L-Enantiomer)
- 4042-36-8 (D-Enantiomer)
- 149-87-1 (DL-Form (Racemat))
Eigenschaften Molare Masse 129,11 g·mol−1 Aggregatzustand fest
Schmelzpunkt 162–163 °C (L-Enantiomer) [1]
Löslichkeit löslich in Wasser, Ethanol und Aceton [1]
Sicherheitshinweise Gefahrstoffkennzeichnung 
unbekannt R- und S-Sätze R: ? S: ? Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Pyroglutaminsäure ist ein Derivat der Glutaminsäure und zählt nicht zu den Aminosäuren. Pyroglutaminsäure zählt zu den chiralen Verbindungen und besitzt ein stereogenes Zentrum in der 2-Position am Pyrrolidinring. Es existieren also zwei Enantiomere: L-Pyroglutaminsäure [Synonym: (S)-Pyroglutaminsäure] und D-Pyroglutaminsäure [Synonym: (R)-Pyroglutaminsäure].
Inhaltsverzeichnis
Vorkommen
L-Pyroglutaminsäure ist ein cyclisiertes inneres Amid der L-Glutaminsäure und ist enthalten in Gemüse, Früchten, Gräsern und in Melasse.[1] Peptide mit N-terminalem L-Glutamin, dessen Aminofunktion ungeschützt ist, werden leicht in Pyroglutamyl-Peptide umgewandelt.[2]
Gewinnung und Darstellung
Beim Erhitzen einer Mischung aus gleichen Gewichtsteilen Glutaminsäure und Wasser in einem Autoklaven erhält man bei Reaktionstemperaturen von 135–140 °C Pyroglutaminsäure.
Chemische Eigenschaften
Die Carboxylgruppe der L-Pyroglutaminsäure kann mit Alkoholen im sauren Medium zu L-Pyroglutaminsäureestern verestert werden, die Lactamfunktion bleibt dabei unverändert. Durch Behandeln mit Phosphorpentasulfid wird die Lactamfunktion der L-Pyroglutaminsäureester in eine Thiolactamfunktion umgewandelt.
D- und ebenso L-Pyroglutaminsäure zählen nicht zu den Aminosäuren, weil neben der sauren Carboxylgruppe keine basische Aminogruppe im Molekül vorhanden ist, da der Stickstoff im Fünfring Teil eines Lactams (cyclisches Amid) ist. Zugleich sind D- und ebenso L-Pyroglutaminsäure Derivate einer Aminosäure, der D- bzw. L-Glutaminsäure.
Verwendung
Die reinen Enatiomeren der Pyroglutaminsäure, also L-Pyroglutaminsäure und D-Pyroglutaminsäure, werden oft zur Racematspaltung racemischer Amine eingesetzt.[1] Aus L-Pyroglutaminsäure lässt sich auch L-Prolin synthetisieren.[3] Der chirale Hilfsstoff RAMP wurde aus D-Pyroglutaminsäure synthetisiert.[4] Die Verwendung beider Enantiomeren der Pyroglutaminsäure in weiteren stereoselektiven Synthesen wurde in in einem Übersichtsartikel beschrieben. [5] Der Naturstoff Domoinsäure wurde in einer vielstufigen Synthese aus (S)-Pyroglutaminsäure synthetisiert.[6]
Einzelnachweise
- ↑ a b c d The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1373, ISBN 978-0-911910-00-1.
- ↑ Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, 1982, S. 139, ISBN 3-527-25892-2.
- ↑ Karlheinz Drauz, Axel Kleemann, Jürgen Martens, Paul Scherberich und Franz Effenberger (1986): Amino Acids 7. A Novel Synthetic Route to L-Proline. In: J. Org. Chem. Bd. 51, S. 3494-3498.
- ↑ Dieter Enders, Herbert Eichenauer und Reimund Pieter: Enantioselektive Synthese von (−)-(R)- und (+)-(S)-[6]-Gingerol - Gewürzprinzip des Ingwers, Chemische Berichte 112 (1979) 3703-3714.
- ↑ Carmen Nájera und Miguel Yus: Pyroglutamic acid: a versatile building block in asymmetric synthesis, Tetrahedron: Asymmetry 10 (1999) 2245-2303.
- ↑ Y. Ohfune und M. Tomita, Journal of the American Chemical Society 104 (1982) 3511.
Wikimedia Foundation.
