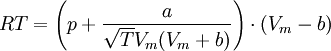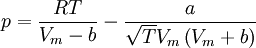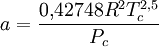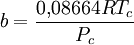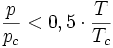Redlich-Kwong-Soave-Gleichung — Die Zustandsgleichung von Redlich Kwong Soave[1] ist eine Zustandsgleichung für reale Gase. Sie lautet: Die einzelnen Formelzeichen stehen für folgende Größen: Vm … Deutsch Wikipedia
Zustandsgleichung von Redlich-Kwong — Die Zustandsgleichung von Redlich Kwong ist eine Zustandsgleichung für reale Gase. Sie lautet: Die einzelnen Formelzeichen stehen für folgende … Deutsch Wikipedia
Zustandsgleichung von Redlich-Kwong-Soave — Die Zustandsgleichung von Redlich Kwong Soave[1] ist eine Zustandsgleichung für reale Gase. Sie lautet: Die einzelnen Formelzeichen stehen für folgende Größen: Vm molares Volumen … Deutsch Wikipedia
Predictive Soave-Redlich-Kwong — PSRK (kurz für Predictive Soave Redlich Kwong) [1] ist ein Abschätzverfahren für die Berechnung von Phasengleichgewichten von Gemischen chemischer Stoffe. Die ursprüngliche Zielsetzung war es, die Eigenschaften von Gemischen, die auch… … Deutsch Wikipedia
Van der Waals-Gleichung — Die Van der Waals Gleichung ist eine angenäherte Zustandsgleichung für reale Gase. Sie wurde 1873 durch Johannes Diderik van der Waals aufgestellt, wofür er 1910 den Nobelpreis für Physik erhielt. Gas a in (kPa·dm6)/mol2 b in dm3/mol Helium (He)… … Deutsch Wikipedia
Van der Waals Gleichung — Die Van der Waals Gleichung ist eine angenäherte Zustandsgleichung für reale Gase. Sie wurde 1873 durch Johannes Diderik van der Waals aufgestellt, wofür er 1910 den Nobelpreis für Physik erhielt. Gas a in (kPa·dm6)/mol2 b in dm3/mol Helium (He)… … Deutsch Wikipedia
Van-der-Waals-Gleichung — Die Van der Waals Gleichung ist eine angenäherte Zustandsgleichung für reale Gase. Sie wurde 1873 durch Johannes Diderik van der Waals aufgestellt, wofür er 1910 den Nobelpreis für Physik erhielt. Gas a in (kPa·dm6)/mol2 b in dm3/mol Helium (He)… … Deutsch Wikipedia
Peng-Robinson-Gleichung — Die Zustandsgleichung von Peng Robinson[1] ist eine Zustandsgleichung für reale Gase. Sie lautet: Die einzelnen Formelzeichen stehen für folgende Größen: Vm … Deutsch Wikipedia
Kohäsionsdruck — Die Van der Waals Gleichung ist eine angenäherte Zustandsgleichung für reale Gase. Sie wurde 1873 durch Johannes Diderik van der Waals aufgestellt, wofür er 1910 den Nobelpreis für Physik erhielt. Gas a in (kPa·dm6)/mol2 b in dm3/mol Helium (He)… … Deutsch Wikipedia
Kovolumen — Die Van der Waals Gleichung ist eine angenäherte Zustandsgleichung für reale Gase. Sie wurde 1873 durch Johannes Diderik van der Waals aufgestellt, wofür er 1910 den Nobelpreis für Physik erhielt. Gas a in (kPa·dm6)/mol2 b in dm3/mol Helium (He)… … Deutsch Wikipedia