- Ribulose-1,5-Bisphosphat-Carboxylase
-
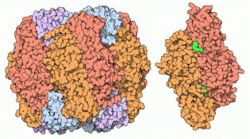
RuBisCO Lange Kette (Arabidopsis thaliana) RuBisCO-Moleküle. Links: von Pflanzen und Algen (16-mer). Rechts: von Bakterien (Dimer) nach PDB 1RCX und 9RUB Vorhandene Strukturdaten: 1RBL Größe 477 AS; 52,7 kDa Struktur Hetero-16-mer (8 große + 8 kleine UE) Kofaktor Mg2+ Bezeichner Externe IDs UniProt: O03042 CAS-Nummer: 9027-23-0 Enzymklassifikation EC, Kategorie 4.1.1.39 Lyase Substrat D-Ribulose-1,5-Bisphosphat + CO2 + H2O Produkte 2 3-Phospho-D-Glycerat + 2 H+ Das Enzym Ribulose-1,5-bisphosphat-carboxylase/-oxygenase (RuBisCO) ist dafür verantwortlich, dass alle photosynthetisch aktiven Pflanzen und Bakterien Kohlendioxid aufnehmen können, weshalb es vermutlich das mengenmäßig häufigste Protein der Erde ist. Als einleitender Schritt im Calvin-Zyklus bindet RuBisCO ein Molekül Kohlendioxid und baut dessen Kohlenstoffatom in zwei Phosphoglycerat-Moleküle ein, aus denen nach wenigen weiteren Schritten Glucose (Traubenzucker) entsteht. Die Energie für diese Reaktionen kommt in Form von ATP von der Photosynthese, also vom Sonnenlicht, oder, wie im Fall einiger chemolithotrophen Bakterien, aus den Reaktionen der Chemosynthese.
Neben der Kohlenstoffdioxid-Fixierung katalysiert RuBisCO auch die konkurrierende Reaktion der Sauerstoff-Fixierung, wenn wenig oder kein Kohlendioxid vorhanden ist. Dabei wird das ursprüngliche Substrat Ribulose-1,5-bisphosphat in Phosphoglycerat und Phosphoglycolat umgewandelt (Photorespiration). Bei Normalbedingungen laufen beide Reaktionen gleichzeitig ab. Die Aktivität von RuBisCO ist vom Licht abhängig. RuBisCO muss vor der enzymatischen Aktivität durch eine lichtabhängige Aktivase aktiviert werden.
Inhaltsverzeichnis
Biosynthese
In Pflanzen wird RuBisCO in den Chloroplasten der Zelle gebildet. Eine Besonderheit ist, dass die acht identischen großen Untereinheiten im Chloroplastengenom und die acht identischen kleinen Untereinheiten des Enzyms im Zellkerngenom kodiert sind. Bei der Ackerschmalwand (Arabidopsis thaliana) ist das Gen für die lange Kette 1.440 Basenpaare lang und resultiert nach Transkription, Translation und posttranslationaler Modifikation in dem 477 Aminosäuren enthaltenden Protein. Die kurzen Ketten bestehen bei Arabidopsis aus 126 Aminosäuren.[1][2]
Die Tertiärstruktur des Enzyms ist (L2S2)4, wobei das katalytische Zentrum von einem Paar der "L"-(´large´) Untereinheiten gebildet wird; jede von diesen bindet eines der Produktmoleküle 3-Phosphoglycerat (3-PG; vergl. Calvinzyklus). Die "S"-(´small´) Untereinheit übernehmen Aspekte der Regulation. Insgesamt lagern sich also acht lange und acht kurze Ketten zum zylinderförmigen Heterohexadekamer zusammen.
Katalysierte Reaktionen
Als Kofaktor von RuBisCO agiert Magnesium.
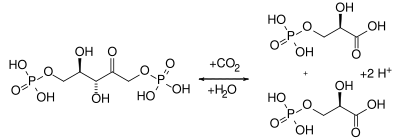
In der Dunkelreaktion (Calvin-Zyklus) wird ein Molekül Ribulose-1,5-bisphosphat mit Kohlenstoffdioxid zu zwei Molekülen 3-D-Phosphoglycerat umgesetzt. Damit befindet sich das Kohlenstoffatom des Kohlendioxids nun innerhalb des pflanzlichen Stoffwechsels (Kohlenstoffdioxid-Fixierung).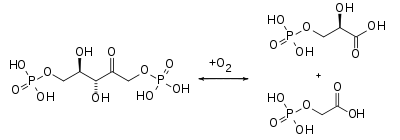
Bei der Fixierung von Sauerstoff durch RuBisCO fällt stattdessen ein Molekül 2-Phosphoglycolat an, das in größeren Mengen giftig wirkt und daher über die Photorespiration entsorgt werden muss.Landpflanzen fixieren jährlich schätzungsweise 120 Gigatonnen (109 t = 1 Milliarde Tonnen) Kohlenstoff aus CO2. Dies ist etwa ein Sechstel des gesamten atmosphärischen CO2 und entspricht ca. dem 17- bis 20-fachen der jährlich durch anthropogene Aktivitäten in die Atmosphäre freigesetzten CO2-Menge. Davon bleiben derzeit jährlich etwa 1-2 Gigatonnen Kohlenstoff durch Akkumulation von Biomasse und von organischer Substanz im Boden netto in den terrestrischen Ökosystemen gespeichert. Der Rest wird durch autotrophe und heterotrophe Atmung wieder in die Atmosphäre abgegeben.[3] Zur Fixierung sind 0,2% des auf der Erde vorkommenden Gesamtproteins erforderlich (auf jeden Erdenbürger entfallen, gleichmäßig verteilt, 10 kg RuBisCO);
Mit einer Wechselzahl von 17/s (in der lebenden Zelle: 3/s) und der verlustreichen Nebenreaktion der Photorespiration erscheint die RuBisCO widersinnigerweise als eines der am schlechtesten optimierten (oder meist verkannten) Enzyme. Daher hat es nicht an Versuchen gefehlt, seine Eigenschaften auf dem Wege der Gentechnologie zu verändern, um theoretische Ertragssteigerungen von bis zu 100% zu erzielen.[4]
Neuere Ergebnisse zeigen, dass die RuBisCO ihre Reputation langsam und ineffizient zu sein, zu unrecht hat. Eine detaillierte Untersuchung legt nahe, dass die verschiedenen Varianten von RuBisCO wahrscheinlich nahezu optimal an ihre jeweiligen atmosphärischen und thermischen Umgebungen angepasst sind.[5]
Regulation
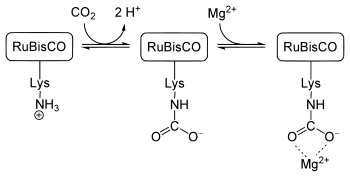
RuBisCO wird durch eine Carbamatylierung eines L-Lysins reguliert. Dieses Lysin ist an Position 201 der großen Untereinheit lokalisiert. Ein Kohlenstoffdioxidmolekül reagiert hierbei mit der ε-Aminogruppe des Lysins zu einem Carbamat (vgl. Bild mitte). RuBisCO ist aber erst dann aktiv, wenn jenes Lysin als Carbamat vorliegt und zudem ein Magnesiumion an dieses Carbambat bindet (vgl. Bild rechts). Dies bewirkt eine Konformationsänderung (das Magnesiumion stabilisiert diese), in dessen Folge die große Untereinheit enzymatisch aktiv werden kann.
Das Kohlenstoffdioxidmolekül, dass mit der ε-Aminogruppe des Lysins zu einem Carbamat reagiert, hat nichts mit dem CO2-Molekül zu tun, dass enzymatisch in der Carboxylasereaktion (siehe weiter oben) umgesetzt wird.
Einzelnachweise
- ↑ UniProt-Eintrag
- ↑ GermOnline-Eintrag
- ↑ Prentice, I.C., G.D. Farquhar, M.J.R. Fasham, M.L. Goulden, M. Heimann, V.J. Jaramillo, H.S. Kheshgi, C. Le Quéré, R.J. Scholes, D.W.R. Wallace (2001). The Carbon Cycle and Atmospheric Carbon Dioxide. In: Climate Change 2001: The Scientific Basis. Contribution of Working Group I to the Third Assessment Report of the Intergovernmental Panel on Climate Change [Houghton, J.T.,Y. Ding, D.J. Griggs, M. Noguer, P.J. van der Linden, X. Dai, K. Maskell, and C.A. Johnson (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA, 881pp.
- ↑ Turbo für Biokraftstoff, Artikel in Chemie-Online vom 18.6.2007. [1]
- ↑ Tcherkez, G.G. et al. (2006): Despite slow catalysis and confused substrate specificity, all ribulose bisphosphate carboxylases may be nearly perfectly optimized. In: Proc. Natl. Acad. Sci. Bd. 103, S. 7246-7251. PMID 16641091
Literatur
- Hans W. Heldt und Birgit Piechulla: Pflanzenbiochemie. Spektrum Akademischer Verlag GmbH, 4. Auflage 2008; ISBN 978-3-8274-1961-3; S. 161ff.
- Caroline Bowsher, Martin Steer und Alyson Tobin: Plant Biochemistry. Garland Pub 2008; ISBN 978-0-8153-4121-5; S. 97ff.
Wikimedia Foundation.