- Ritter-Reaktion
-
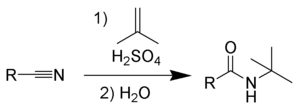
Die Ritter-Reaktion ist nach dem US-amerikanischen Chemiker John Joseph Ritter benannt und dient zur Herstellung von N-alkyl-Amiden aus Nitrilen und Substraten, die Carbeniumionen bilden können (etwa verschiedene Alkylierungsmittel wie z. B. Isobutylen in Gegenwart von starken Mineralsäuren).[1][2][3]
Primäre[4], sekundäre[5] und tertiäre Alkohole[6] sowie Benzylalkohol [7] und tert-Butylacetat[8] reagieren sehr gut.
Reaktionsmechanismus
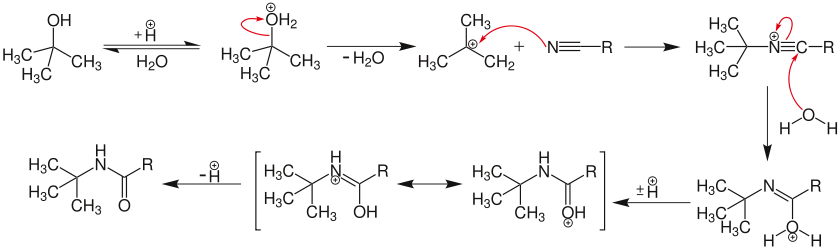
Die Ritter-Reaktion wird eingeleitet durch die elektrophile Addition entweder eines Carbeniumions 2 oder kovalente Reaktionspartner[9][10] zum Nitril. Das daraus resultierende Nitrilion 3 wird mit Wasser zum Amid 5 hydrolysiert.
Einzelnachweise
- ↑ Ritter, J. J., Minieri, P. P.; J. Am. Chem. Soc. 1948, 70, 4045.
- ↑ Ritter, J. J., Kalish, J.; J. Am. Chem. Soc. 1948, 70, 4048.
- ↑ Krimen, L. I., Cota, D. J.; Org. React. 1969, 17, 213-325 (Übersichtsartikel).
- ↑ Lebedev, M. Y., Erman, M. B.; Tetrahedron Lett. 2002, 43, 1397-1399; doi:10.1016/S0040-4039(02)00057-6.
- ↑ Bishop, R.; In Comp. Org. Synth.; Trost, B.M., Fleming, I.; Eds.; Pergamon Press: New York, 1992; Vol. 6, 261-300 (Übersichtsartikel).
- ↑ Ritter, J. J., Kalish, J.; Organic Syntheses, Coll. Vol. 5, p.471 (1973); Vol. 44, p.44 (1964). (Article).
- ↑ Parris, C. L.; Organic Syntheses, Coll. Vol. 5, p.73 (1973); Vol. 42, p.16 (1962). (Article)
- ↑ Fernholz, H., Schmidt, H.J.; Angew. Chem., Int. Ed. Eng., 1969, 8, 521; doi:10.1002/anie.196905211.
- ↑ Booth, B.L., Jibodu, K.O., Proenca, F.J.R.P.; J. Chem. Soc., Perkin Trans. 1, 1983, 1067–1073; doi:10.1039/P19830001067.
- ↑ Martínez, A.G., Alvarez, R.M., Vilar, E.T., Fraile, A.G., Hanack ,M., Subramanian, L. R.; Tetrahedron Lett. 1989, 30, 581-582; doi:10.1016/S0040-4039(00)95260-2.
Wikimedia Foundation.