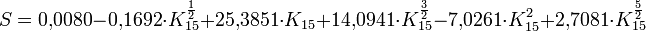- Salzgehalt
-
Als Salinität (von lateinisch: salinitas) bezeichnet man (vereinfachend) den Salzgehalt eines Gewässers, Wasserkörpers bzw. Wassers. Im einfachsten Fall wird sie als Massenanteil in g/kg Wasser oder in Prozent angegeben (1 % entspricht 10 g/kg). Heute üblich und empfohlen ist die Angabe in der dimensionslosen Einheit PSU (Practical Salinity Units). Die Salinität kann mithilfe eines Salinometers bestimmt werden.
Inhaltsverzeichnis
Geschichte der Salinitätsbestimmung
Mit der Salinitätsbestimmung will man herausfinden, wie viel Salz in einer Menge von Wasser gelöst ist.
Verdunstung
Die ursprünglichste Methode ist die Verdunstung von Wasser und die Wägung dessen, was nicht verdunstet ist. Das Problem ist, dass Wasser dabei in Salzkristallen eingeschlossen werden kann. Um dieses Wasser aus den Salzkristallen zu lösen, sind hohe Temperaturen notwendig. Durch die hohe Temperatur zerfallen jedoch einige Salze (z.B. MgCO3 → MgO + CO2). Schon Robert Boyle stellte im 17. Jahrhundert fest, dass die Trocknung und Wägung von Meerwasser zu wenig reproduzierbaren Ergebnissen für die Konzentration von gelösten Substanzen führte.
Im 19. Jahrhundert wurde das Marcet-Prinzip oder auch das Gesetz der konstanten Proportionen formuliert. Es besagt: Ungeachtet wie stark sich die Salinität von Ort zu Ort unterscheidet, die Anteile der wichtigsten Ionen (engl. Major Ions) im Wasser des offenen Ozeans sind fast konstant zueinander.
Anfang des 20. Jahrhunderts kamen neue Methoden zur Bestimmung des Salzgehaltes auf.
Salinität, S‰ (Knudsen, 1902)
Um reproduzierbare Ergebnisse zu bekommen, wurde eine erste strikte Definition eingeführt. „Salinität ist definiert als das Gewicht in Gramm der gelösten anorganischen Stoffe in einem Kilogramm Seewassers, nachdem alle Bromide und Iodide mit der gleichen Menge an Chloriden ersetzt wurden und alle Kohlenstoff-Verbindungen oxidiert wurden.“ D. h. alle Kohlenstoffverbindungen gasten als CO2 aus. Dazu wurde das Seewasser, HCL und gesättigtes Chlorwasser getrocknet, für 72 Stunden bei 480 °C erhitzt und schließlich das rückständige Chlorid titriert.
Diese Methode brachte nun zwar reproduzierbare Ergebnisse, war aber sehr umständlich und zur Anwendung auf See nur sehr bedingt geeignet.
Chlorinität, Cl‰ (Sørensen and Knudsen, 1902)
Durch das Gesetz der konstanten Proportionen ist es möglich, aus dem Gehalt eines Salzes den Gehalt der restlichen Salze recht genau abzuschätzen. Mit Hilfe der Mohr-Titration konnte die Menge der Halogeniden in Seewasser bestimmt werden. Bei der Anwendung mit Seewasser fällt neben Silberchlorid noch Silberbromid und Silberiodid aus, welches nun gewogen werden kann. Damit die Ergebnisse präzise sind, wird die Silbernitrat-Lösung gegen sogenanntes Standard Seewasser mit bekannter Chlorinität geeicht. Um nun aus der ermittelten Chlorinität die Salinität zu berechnen, maß Sørensen die Salinität von neun Seewasserproben direkt und bestimmte außerdem die Chlorinität. Die daraus abgeleitete Korrelation war: Salinität [‰] = 1,805 * Chlorinität [‰] + 0,030
Diese Methode ist sehr genau und auch auf See wesentlich besser anwendbar als die von 1902.
Chlorinität, Cl‰ (UNESCO, 1962)
Wie die Addition eines konstanten Wertes in der obigen Korrelation schon vermuten lässt, gab es jedoch ein Problem. Die neun Proben stammten zum Teil aus der Ostsee. Die Ostsee hat jedoch eine andere Ionenkomposition als der offene Ozean. Dieser Fehler wurde durch eine neue Kalibrierung nach nun 60 Jahren korrigiert: Salinität [‰] = 1,80655 * Chlorinität [‰]
Practical Salinity Scale, S (1978)
Die heute verwendete Practical Salinity Scale (PSS-78[1]) beruht auf der Proportionalität von Salzgehalt und elektrolytischer Leitfähigkeit und ist dimensionslos. Häufig findet man jedoch zur Angabe der Salinität nachfolgend ein PSU, welches für Practical Salinity Unit steht. Dies ist keine physikalische Einheit.
Zur Errechnung des Salzgehaltes aus der Leitfähigkeit wird folgende Formel benutzt:
Dabei gibt K15 das Verhältnis von der gemessenen Leitfähigkeit zur Leitfähigkeit einer Kalium-Chlorid-Lösung bei 15 °C und einer Atmosphäre Druck an. Ist das Verhältnis K15 gleich eins, ist S = 35.
Die Messung der Leitfähigkeit erfolgt heutzutage meist automatisiert mit Hilfe einer Conductivity Temperature Depth-Sonde (CTD), auf deutsch einer Leitfähigkeit-Temperatur-Tiefensonde.
Salzgehalte
Einordnung
Süßwasser weist eine Salinität von unter 0,1 % auf. Der durchschnittliche Salzgehalt der Ozeane liegt bei ca. 3,5 %. Eine isotonische Kochsalzlösung oder auch physiologische Kochsalzlösung enthält 0,9 % Kochsalz. Eine gesättigte Kochsalzlösung enthält 356 g/L Natriumchlorid bei 0 °C (359 g/L bei 25 °C).
Die zehn Hauptbestand-
teile des MeersalzesChlorid 55,04 Natrium 30,61 Sulfat 7,68 Magnesium 3,69 Calcium 1,16 Kalium 1,10 Bikarbonat 0,41 Bromid 0,19 Borat 0,07 Strontium 0,04 Die wichtigsten gelösten Salzionen des Meerwassers haben in den Weltmeeren den gleichen Anteil an der Salinität, sie sind konservativ. Das heißt, auch bei unterschiedlicher Salinität ist der Anteil der Ionen zueinander der gleiche. Dies liegt daran, dass sie nach ihrem Eintrag ins Meer nicht mehr nennenswert von biologischen oder geochemischen Prozessen beeinflusst werden.
Ozeane
- Atlantik: 3,54 %
- Indischer Ozean: 3,48 %
- Pazifik: 3,45 %
Weitere Meere
- Ostsee: 0,8 %
- Kieler Bucht: 1,5 %
- Finnischer und Bottnischer Meerbusen: 0,1 %
- Nordsee: 3,5 %
- Flussmündungen: 1,5-2,5 %
- Nördliche Nordsee: 3,2-3,5 %
- Mittelmeer: 3,74 %
- Schwarzes Meer 1,7 - 1,8 %
- Persischer Golf: 4 %
- Rotes Meer: 4 %
Bei den anderen Nebenmeeren liegt die Salinität zwischen 3 und 4 %.
Binnenseen
- Kaspisches Meer: 1,3 %
- Mono Lake: 7,3 %
- Totes Meer: 27 % (Durchschnitt)
- Totes Meer: 32,66 % in einer Tiefe von 50 Metern
- Assalsee: 34,8 % (Durchschnitt, welthöchster Wert für ein Gewässer)
- Assalsee: 38,8 % in einer Tiefe von 20 Metern
Natürliche Schwankungen in Gewässern
Durch den Einfluss von Wetter und Gezeiten unterliegt die Salinität natürlichen Schwankungen. Zum einen das Ansteigen der Salinität durch Verdunstung bei Ebbe in ufernahen Bereichen (Wattenmeer, Gezeitentümpel) bis hin zur Ausbildung von Salzwiesen, zum Beispiel durch längere Sonnenperioden nach Sturmfluten. Bei Vorliegen einer wasserundurchlässigen Schicht kann sich sogar stark salzhaltiges Grundwasser bilden, das auf Læsø in Dänemark eine Salinität von bis zu 15 Prozent erreicht. Eine Herabsetzung der Salinität kann sich durch Süßwassereintrag in Flussmündungen, in Schmelzwasserzonen und bei starkem Regen ergeben.
In der Ozeanografie wird Salinität als Kenngröße bei der Bestimmung von Wassermassen eingesetzt und mit Salinometern manuell oder automatisch gemessen. Zusammen mit anderen Wassermasseneigenschaften lassen sich mit ihrer Kenntnis Aussagen über die Entstehung und Ausbreitung von Wassermassen treffen.
Verweise
Einzelnachweise
- ↑ http://ioc.unesco.org/oceanteacher/OceanTeacher2/01_GlobOcToday/02_CollDta/02_OcDtaFunda/03_T&SScales/TemperatureAndSalinityScales.htm
Weblinks
- Gerd Liebezeit (Forschungszentrum Terramare): Skript zur Vorlesung „Meereschemie 1“ (pdf)
- UNESCO: International oceanographic tables (pdf)
- Sönke Maus, Geophysical Institute Bergen (Measurements of Salinity and Conductivity: Principles and Challenges (pdf))
Siehe auch
Wikimedia Foundation.