- Meerwasser
-
Der größte Teil der Erdoberfläche ist von Meerwasser bedeckt. Meerwasser ist chemisch gesehen eine wässrige Lösung, hauptsächlich von verschiedenen Salzen (Salzwasser). Natürliches Meerwasser enthält jedoch darüber hinaus noch eine Vielzahl anderer Bestandteile (siehe unten).
Inhaltsverzeichnis
Salzgehalt
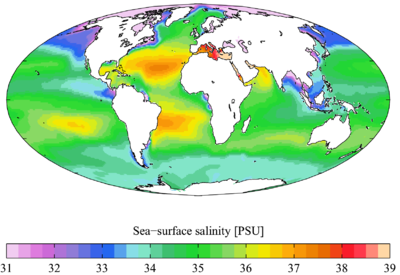
Meerwasser hat einen durchschnittlichen Salzgehalt (Salinität) von 3,5 % Massenanteil. Der Gesamtsalzgehalt schwankt je nach Meer. Die Ostsee hat einen Salzgehalt von 0,2 bis 2 %. Einige Binnenseen ohne Abfluss haben weit höhere Salzanteile im Wasser; das Tote Meer ist für seinen Salzgehalt von 28 % bekannt.
Der Mittelwert gilt somit vor allem für das Hauptvolumen der Ozeane und auch für die meisten Nebenmeere wie etwa die Nordsee. 1819 entdeckte Alexander Marcet, dass das Verhältnis der Haupt-Ionen des Meerwassers in allen Ozeanen genau gleich ist. Dieses Prinzip der konstanten Proportionen gilt unabhängig vom Gesamtsalzgehalt des jeweiligen Meeres.
Das Salz ist im Meerwasser dissoziiert, also in Ionen gespalten. Letztere werden erst beim Eindampfen des Wassers zu Salzen, die sich entsprechend ihrer Löslichkeit bilden und in Schichten ablagern. Der Hauptanteil der Anionen ist das Chloridion, gefolgt vom Sulfation. Bei den Kationen überwiegt das Natriumion, weshalb die Hauptmenge der auskristallisierten Meeressalze aus Natriumchlorid (Kochsalz) besteht. Magnesium-, Calcium- und Kalium-ionen sind mit geringeren Anteilen vertreten. In Spuren sind noch weitere Ionen enthalten, davon ist das Spurenelement Iod erwähnenswert, weil infolgedessen in früheren Zeiten in Küstennähe weniger Menschen an Iodmangel litten als im Inland.
Salzbilanz
Der Gefrierpunkt des Meerwassers liegt bei −1,9 °C bei einem durchschnittlichen Salzgehalt von 3,5 %. Die Salze werden durch Regen und Schmelzwasser aus den Böden und Gesteinsschichten des Festlandes ausgewaschen und von Fließgewässern in die Meere eingetragen. Durch Verdunstung wird die ursprünglich verdünnte Salzlösung weiter konzentriert, und es entsteht salziges Meerwasser. Dieser Effekt würde den Salzgehalt der Meere langsam, aber kontinuierlich steigen lassen, wenn nicht gleichzeitig Salz dem Meer wieder entzogen würde. Dies geschieht erstens durch die Austrocknung von Meeren, wodurch das Salz wieder auf dem Festland abgelagert wird. Dieses Salz findet sich später dann z. B. in Salzstöcken wieder. Zweitens wird Meerwasser in den Poren der Sedimente auf dem Meeresboden eingeschlossen und so das Salz dem Wasser entzogen. Der zweite Vorgang ist der bedeutendere.
Saline Binnenseen
Neben der Anreicherung von Salz in den Weltmeeren kommt es zu einer Anreicherung von Salz in allen Gewässern mit hohen Verdunstung und geringem bis fehlendem Abfluss.
Neben Seen mit extrem hohem Salzgehalt, die als Salzseen bezeichnet werden (z.B. Totes Meer, Großer Salzsee in Utah mit einem Salzgehalt über 25 %) gibt es diesen Effekt auch in gemäßigter Form, z.B. im Neusiedler See mit einem Salzgehalt von 0,2 %. Salzseen sind im Durchschnitt Seen mit einer geringen durchschnittlichen Wassertiefe. Mit der geringen Wassertiefe entstehen weiterhin zwei Erscheinungen: zum einen variiert der Salzgehalt in Abhängigkeit des Ortes (flache Stellen versalzen) wie auch zeitlich (in der Trockenzeit steigt der Salzgehalt).
Die Zusammensetzung des Salzes in Salzseen unterscheidet sich z.T. erheblich von denen in den Weltmeeren. Insbesondere in sulfatarmen Gewässern (Totes Meer, Don-Juan-See) können sich Calciumionen anreichern, die in den Weltmeeren nur mit geringer Konzentration zu finden sind. Karbonatreiche Seen haben einen hohen pH-Wert und werden als Sodaseen bezeichnet.
Neben dem Entstehen von Salzseen durch Verdunstungsanreicherung gibt es auch seltene Fälle des direkten Entstehens von Salzseen auf salzreichem Untergrund, z.B. bei Ocna Sibiului (ehemalige Salzgewinnung im Tagebau).
Weitere Gehaltsstoffe
Neben den Salzen sind im Meerwasser (ebenso wie in anderen Oberflächengewässern) Kohlendioxid (CO2), Sauerstoff (O2) und andere atmosphärische Gase gelöst. Die Speicherfähigkeit für das Treibhausgas CO2 hängt unter anderem mit der Wassertemperatur zusammen und ist ein wichtiger Faktor für das Weltklima. Gelöster Sauerstoff ist Grundlage für die Atmung der Wasserorganismen, so z. B. für Fische, die ihren Gasaustausch über Kiemen bewältigen.
Schließlich finden sich im Meerwasser organische Verbindungen aus „natürlichen“ Quellen und durch Umweltverschmutzung.
Ungefiltertes Meerwasser enthält suspendierte feine Partikel, Mikroorganismen und Plankton.
Die Dichte des Meerwassers liegt (wiederum abhängig vom Salzgehalt) zwischen 1020 und 1030 kg·m-3. Der pH-Wert ist leicht alkalisch und liegt zwischen 7,5 und 8,4. Durch die zunehmende Konzentration an Kohlendioxid in der Atmosphäre nimmt der pH-Wert langsam ab („Versauerung der Meere“).
Meerwasserentsalzung
Mit unterschiedlichen Verfahren der Meerwasserentsalzung lässt sich der Anteil der gelösten Stoffe so weit verringern, dass man trinkbares Wasser erhält. Entsprechende Anlagen werden in vielen heißen Regionen dieser Erde betrieben. Sämtliche Verfahren sind allerdings im Betrieb oder bei der Errichtung so teuer, dass sie nur in Tourismus-Regionen beziehungsweise wohlhabenden Siedlungen zum Einsatz kommen.
Siehe auch
Literatur
- Oliver Wurl: Practical guidelines for the analysis of seawater. CRC Press, Boca Raton 2009, ISBN 978-1-4200-7306-5.
- Klaus Graßhoff, et al.: Methods of seawater analysis. Wiley-VCH, Weinheim 1999, ISBN 3-527-29589-5.
Weblinks
- www.wissenschaft.de: Wie Meerwasser gefriert Simulation zeigt, warum das Eis weniger salzig ist als das Wasser
Wikimedia Foundation.