- Schalenstruktur
-
Die Elektronenkonfiguration gibt die Verteilung der Elektronen in der Elektronenhülle eines Atoms auf verschiedene Energiezustände bzw. Aufenthaltsräume (Orbitale) an.
Inhaltsverzeichnis
Quantenzahlen und Schalen
Der Zustand jedes Elektrons der Hülle wird nach dem Atommodell von Bohr-Sommerfeld sowie des Orbitalmodells durch vier Quantenzahlen bestimmt.
Quantenzahl Zeichen Wertebereich Bezeichnung Beispiel Hauptquantenzahl n 1, 2, 3, ... K, L, M,... 3 Nebenquantenzahl l 0, ..., n-1 s, p, d, f,... 0, 1, 2 magnetische Quantenzahl m -l, ..., l 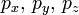
-2, -1, 0, 1, 2 Spinquantenzahl s -1/2, +1/2 ↓, ↑ -1/2, +1/2 Gemäß dem Pauli-Prinzip darf der Zustand keines Paars von Elektronen eines Atoms in allen vier Quantenzahlen übereinstimmen. Das ist der Grund dafür, dass sich die Elektronen auf die verschiedenen erlaubten Zustände und damit auf die Schalen und Unterschalen verteilen.
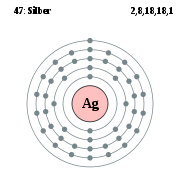
Die Hauptquantenzahlen bilden die Schalen, die Nebenquantenzahlen die Unterschalen. Jede Schale kann gemäß den Beschränkungen von l, m und s mit maximal 2n² Elektronen besetzt werden. Die Schalen werden aufsteigend mit K, L, M, N, O, P, Q bezeichnet.
Die äußerste, besetzte Schale (Valenzschale) bestimmt das chemische Verhalten und ist daher Maßstab für die Einordnung ins Periodensystem.
Auffüllen der Schalen
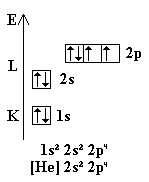
Mit steigender Elektronenzahl der Elemente werden die möglichen Zustände ihrer Energie entsprechend bei den niedrigen Energien beginnend besetzt. Gemäß den Hundschen Regeln werden dabei die Orbitale gleicher Energie zuerst einfach, dann doppelt belegt.
Die Unterschalen werden in folgender Reihenfolge besetzt (zeilenweise geordnet):
1s (1. Periode) 2s 2p (2. Periode) 3s 3p (3. Periode) 4s 3d 4p (4. Periode) 5s 4d 5p (5. Periode) 6s 4f 5d 6p (6. Periode) 7s 5f 6d ... (7. Periode)
Von dieser Reihenfolge gibt es mehrere Ausnahmen, unter anderen:
- Bei Lanthan besetzt zuerst ein Elektron ein Orbital der 5d-Unterschale bevor 4f aufgefüllt wird, bei Actinium besetzt entsprechend ein Elektron 6d bevor 5f aufgefüllt wird. Die Elektronen besetzen zuerst leere Orbitale innerhalb einer Unterschale.
- Bei Kupfer und Chrom wechselt ein Elektron des 4s Orbitals in das 3d Orbital, sodass das 4s Orbital trotz seines niedrigeren Energieniveaus nur einfach besetzt ist. Allerdings sind so die d-Orbitale halb (Chrom) bzw. vollständig (Kupfer) besetzt.
- Weitere Ausnahmen sind: Nb, Mo, Tc, Ru, Rh, Pd, Ag, Ir, Pt, Au, Gd und einige Actinoide: Ac bis Np und Cm.
Zusammenhang mit dem Periodensystem
Im Periodensystem entspricht die Besetzung des s-Orbitals einer neuen Schale dem Sprung in eine neue Periode. Innerhalb einer Periode werden zuerst die s-Orbitale (2 Elektronen - 1. und 2. Hauptgruppe (Ausnahme: Helium)) und als letzte die p-Orbitale (6 Elektronen - 3. bis 8. Hauptgruppe) besetzt. Die Nebengruppen entsprechen dem Besetzen der d-Orbitale (10 Elektronen - 10 Nebengruppen). Die Lanthanoide und Actinoide entsprechen der Besetzung der f-Orbitale (14 Elektronen).
Notation
Die Elektronenkonfiguration eines Atoms wird durch Angeben der besetzten Unterschalen beschrieben. Der Nummer der Schale folgt dabei der Buchstabe für die Unterschale und hochgestellt die Anzahl der Elektronen in der Schale. So ergibt sich für die mit 5 Elektronen besetzte 2. Unterschale (p bzw. l = 1) der 3. Schale (M bzw. n = 3) die Schreibweise 3p5. Bei mehreren Unterschalen wird die gemeinsame Schale weggelassen. Aus 2s2 2p3 wird 2s2 p3. Eine weitere verkürzte Schreibweise erhält man, wenn man das Kürzel für das vorausgegangene Edelgas in eckige Klammern setzt und dann die Unterschalen angibt, die noch zum gewünschten Element fehlen. Diese wird wegen ihrer Kürze im Periodensystem verwendet: Beispiel: Chlor: 1s2 2s2 2p6 3s2 3p5 -> [Ne] 3s2 3p5. Daneben ist noch die anschauliche grafische Darstellung die Zellenschreibweise (Pauling-Schreibweise) üblich.
Quellen
- Erwin Riedel: Anorganische Chemie, 2. Auflage, 1990 (für die Ausnahmen der Regel für die Besetzung der Atomorbitale) ISBN 3-11-012321-5
Weblinks
Wikimedia Foundation.