- Rhodium
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Rhodium, Rh, 45 Serie Übergangsmetalle Gruppe, Periode, Block 9, 5, d Aussehen silbrig weiß metallisch CAS-Nummer 7440-16-6 Massenanteil an der Erdhülle 0,001 ppm[1] Atomar [2] Atommasse 102,90550 u Atomradius (berechnet) 135 (173) pm Kovalenter Radius 142 pm Elektronenkonfiguration [Kr] 4d8 5s1 1. Ionisierungsenergie 719,7 kJ/mol 2. Ionisierungsenergie 1740 kJ/mol 3. Ionisierungsenergie 2997 kJ/mol Physikalisch [2] Aggregatzustand fest Kristallstruktur kubisch flächenzentriert Dichte 12,38 g/cm3 (20 °C)[3] Mohshärte 6 Magnetismus paramagnetisch (χm = 1,7 · 10−4)[4] Schmelzpunkt 2237 K (1964 °C) Siedepunkt 3968 K (3695 °C) Molares Volumen 8,28 · 10−6 m3/mol Verdampfungswärme 495 kJ/mol Schmelzwärme 21,7 kJ/mol Schallgeschwindigkeit 4700 m/s bei 293,15 K Spezifische Wärmekapazität 243[5] J/(kg · K) Elektrische Leitfähigkeit 23,3 · 106 A/(V · m) Wärmeleitfähigkeit 150 W/(m · K) Chemisch [2] Oxidationszustände 0, +1, +2, +3, +4 Oxide (Basizität) Rh2O (amphoter) Normalpotential 0,76 V (Rh3+ + 3e− → Rh) Elektronegativität 2,28 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE (MeV) ZP 101Rh 3,3 a ε 0,542 101Ru 102Rh 207 d β+ 2,323 102Ru β− 1,150 102Pd 102mRh 3,742 a β+ 2,464 102Ru IT 0,141 102Ru 103Rh 100 %
Stabil 104Rh 42,3 s β− 2,441 104Pd β+ 1,141 104Ru 105Rh 35,36 h β− 0,567 105Pd Weitere Isotope siehe Liste der Isotope NMR-Eigenschaften Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [6] Pulver

Gefahr
H- und P-Sätze H: 228 EUH: keine EUH-Sätze P: 210 [6] Gefahrstoffkennzeichnung [7] Pulver

Leicht-
entzündlich(F) R- und S-Sätze R: 11 S: 16-22-24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Rhodium ist ein chemisches Element mit dem Elementsymbol Rh und der Ordnungszahl 45. Es ist ein silberweißes, hartes, unreaktives Übergangsmetall. Im Periodensystem zählt es zusammen mit Cobalt, Iridium und Meitnerium zur 9. Gruppe oder Cobaltgruppe. Rhodium besitzt große Ähnlichkeit zu anderen Platinmetallen wie Platin oder Palladium. Dies betrifft beispielsweise die für Edelmetalle charakteristische geringe Reaktivität und eine hohe katalytische Aktivität.
Rhodium wird daher, oft in Form von Legierungen, vorwiegend als Katalysator eingesetzt. Als wichtiger Bestandteil von Fahrzeugkatalysatoren wird es zur Reduktion von Stickoxiden eingesetzt. Auch in industriellen Prozessen zur Herstellung einiger chemischen Grundstoffe, wie dem Ostwald-Verfahren zur Salpetersäure-Produktion, werden Rhodiumkatalysatoren genutzt. Da das Metall in der Natur sehr selten vorkommt und gleichzeitig eine breite Anwendung findet, zählt es zu den teuersten Metallen überhaupt.
Im menschlichen Körper kommt Rhodium normalerweise nicht vor, eine biologische Bedeutung ist nicht bekannt.[8]
Inhaltsverzeichnis
Geschichte
Rhodium wurde 1803 von William Hyde Wollaston in einem aus Südamerika stammenden Rohplatinerz entdeckt. Im gleichen Erz wurden von Wollaston und Smithson Tennant drei weitere Platinmetalle, Palladium, Iridium und Osmium, entdeckt. Dazu lösten sie das Erz zunächst in Königswasser. Es bildete sich eine lösliche Fraktion und ein schwarzer Rückstand, in dem Tennant Osmium und Iridium fand. Wollaston fällte aus der Königswasserlösung Rhodium und einige weitere Bestandteile mit Zinkpulver. Nach der Abtrennung von Kupfer und Blei mit verdünnter Salpetersäure, erneutem Lösen in Königswasser und Zugabe von Natriumchlorid bildete sich Na3[RhCl6] · n H2O, das beim Verdunsten der Flüssigkeit als rosarotes Salz zurückblieb. Aus diesem konnte Wollaston durch Extraktion mit Ethanol und Reduktion mit Zink das elementare Rhodium gewinnen. Der Name wurde von Wollaston nach dem griechischen ρόδου rhodeos: „rosenrot“ gewählt, da viele Rhodiumverbindungen diese Farbe zeigen.[9]
Die erste Anwendung des neuen Metalls war ab 1820 Spitzen von Schreibfedern, für die Rhodium-Zinn-Legierungen eingesetzt wurden. Diese wurden später jedoch durch härtere Osmium-Iridium-Legierungen abgelöst.[9]
Vorkommen
Rhodium ist nach Rhenium zusammen mit Ruthenium und Iridium eines der seltensten nicht radioaktiven Metalle in der kontinentalen Erdkruste. Sein Anteil beträgt nur 1 ppb[10]. Rhodium kommt in der Natur gediegen vor und ist daher als eigenständiges Mineral anerkannt. Fundorte sind unter anderem die Typlokalität Stillwater in Montana und Goodnews Bay in Alaska. Rhodium ist unter anderem mit anderen Platinmetallen und Gold vergesellschaftet.[11]
Neben dem elementaren Rhodium sind auch einige Rhodiumminerale wie Bowieit, Genkinit oder Miassit bekannt. Diese sind jedoch wie das elementare Rhodium sehr selten und spielen für die Gewinnung keine Rolle. Die wichtigsten Vorkommen des Elements liegen in sulfidischen Nickel-Kupfer-Erzen, die vor allem in Südafrika, Sudbury (Kanada) und Sibirien vorkommen. Auch in mexikanischen Goldlagerstätten kommt Rhodium in nennenswerter Menge vor. Rhodium fällt zusammen mit den anderen Platinmetallen beim Verarbeiten dieser Erze an und muss anschließend von diesen getrennt werden.
Gewinnung und Darstellung
Die Gewinnung von Rhodium ist wie die der anderen Platinmetalle sehr aufwändig. Dies liegt vor allem an der Ähnlichkeit und geringen Reaktivität der Platinmetalle, wodurch sie sich schwer trennen lassen. Ausgangsstoff für die Gewinnung des Rhodiums ist Anodenschlamm, der bei der Kupfer- und Nickelproduktion als Nebenprodukt bei der Elektrolyse anfällt. Dieser wird zunächst in Königswasser gelöst. Dabei gehen Gold, Platin und Palladium in Lösung, während Ruthenium, Osmium, Rhodium und Iridium, sowie Silber als Silberchlorid ungelöst zurückbleiben. Das Silberchlorid wird durch Erhitzen mit Bleicarbonat und Salpetersäure in lösliches Silbernitrat umgewandelt und so abgetrennt.
Um das Rhodium von den anderen Elementen abzutrennen, wird der Rückstand mit Natriumhydrogensulfat geschmolzen. Dabei bildet sich wasserlösliches Rhodiumsulfat Rh2(SO4)3, das mit Wasser ausgelaugt werden kann. Das gelöste Rhodium wird zunächst mit Natriumhydroxid als Rhodiumhydroxid Rh(OH)3 gefällt. Die folgenden Reaktionsschritte sind das Lösen in Salzsäure als H3[RhCl6] und die Fällung mit Natriumnitrit und Ammoniumchlorid als (NH4)3[Rh(NO2)6]. Um elementares Rhodium zu erhalten, wird aus dem Rückstand durch Digerieren mit Salzsäure der lösliche (NH4)3[RhCl6]-Komplex gebildet. Nachdem das Wasser durch Verdampfen entfernt wurde, kann das Rhodium mit Hilfe von Wasserstoff zum Metallpulver reduziert werden.
![\mathrm{2\ {(NH_4)}_{3}{[RhCl_6] + 3 \ H_2} \longrightarrow}](f/6efbd8e7408db45087c0615b2e2c8dba.png)
- Reaktion von Ammoniumhexachlororhodat mit Wasserstoff zu Rhodium
Rhodiumisotope entstehen als Nebenprodukte bei der Kernspaltung von 235U, die aus den abgebrannten Brennelementen extrahiert werden können. Auf Grund der Radioaktivität gibt es jedoch noch keine kommerzielle Anwendung des so erhaltenen Rhodiums.[12]
Rhodium wird nur in geringem Umfang gewonnen, 2005 betrug die Produktion 23,5 Tonnen. 83,2 % der Gesamtproduktion fanden in Südafrika statt. Das zweitgrößte Produktionsland war Russland (11,9 %), gefolgt von Kanada und Simbabwe. Da der Verbrauch durch erhöhte Nachfrage in der Schmuckindustrie gestiegen ist und 2005 mit 25,3 Tonnen über der Produktion lag, ist der Preis stark gestiegen.[13] So lag der Rhodiumpreis 2003 noch bei etwa 475 Dollar (entsprach 2003 etwa 420 Euro) pro Feinunze (etwa 31,1 Gramm)[14], im Juni 2008 zählt es mit einem Preis von über 9700 US-Dollar (etwa 6230 Euro) pro Feinunze zu den teuersten Metallen überhaupt[15], fiel danach jedoch schnell auf einen Preis von unter 1000 Dollar im Dezember 2008. Mittlerweile (23. November 2009) ist der Preis wieder auf über 2500 Dollar angestiegen.[14]
Eigenschaften
Physikalische Eigenschaften
 Kristallstruktur von Rh, a = 380,4 pm
Kristallstruktur von Rh, a = 380,4 pm
Rhodium ist ein silberweißes, hochschmelzendes, hartes Edelmetall. Es ist härter als Gold oder Platin, ist jedoch zäh und dehnbar und lässt sich durch Hämmern bearbeiten. In den meisten Eigenschaften ist es mit den anderen Platinmetallen vergleichbar. So liegt der Schmelzpunkt des Rhodiums von 1966 °C zwischen demjenigen von Platin (1772 °C) und Ruthenium (2310 °C). Die Dichte des Elementes von 12,41 g/cm3 ist vergleichbar mit denen der benachbarten Elemente Ruthenium und Palladium. Rhodium besitzt die höchste Wärme- und elektrische Leitfähigkeit aller Platinmetalle. Unterhalb von 0,9 Kelvin wird Rhodium zum Supraleiter.[12]
Rhodium kristallisiert wie Cobalt und Iridium in einer kubisch-dichtesten Kugelpackung (Kupfer-Typ) in der Raumgruppe
 mit dem Gitterparameter a = 380,4 pm sowie vier Formeleinheiten pro Elementarzelle.[16]
mit dem Gitterparameter a = 380,4 pm sowie vier Formeleinheiten pro Elementarzelle.[16]Chemische Eigenschaften
Als typisches Edelmetall ist Rhodium sehr reaktionsträge. Nach Iridium ist es das am wenigsten reaktive Platinmetall. Es reagiert mit Sauerstoff und Chlor erst bei Temperaturen von 600 bis 700 °C zu Rhodium(III)-oxid beziehungsweise Rhodium(III)-chlorid. Auch das reaktivste Halogen Fluor reagiert nur in der Hitze zu Rhodium(VI)-fluorid. Von Mineralsäuren wird das Metall nicht angegriffen. Eine Ausnahme ist feinstverteiltes Rhodium, das sich sehr langsam in Königswasser und konzentrierter Schwefelsäure löst.
Das Metall reagiert mit einigen Salzschmelzen und lässt sich so aufschließen. Salze, die dies vermögen, sind Natriumhydrogensulfat, Kaliumdisulfat, Cyanide und Natriumcarbonat.
Sauerstoff löst sich in flüssigem Rhodium. Beim Erkalten der Schmelze wird dieser unter Spratzen wieder abgegeben.
Isotope
Es sind insgesamt 33 Isotope sowie weitere 20 Kernisomere des Rhodiums bekannt.[17] Natürliches Rhodium besteht zu 100% aus dem Isotop 103Rh, das Element ist somit eines von 22 Reinelementen. Die langlebigsten künstlichen Isotope sind 101Rh, das mit einer Halbwertszeit von 3,3 Jahren unter Elektroneneinfang zu 101Ru zerfällt, sowie 102mRh, das mit einer Halbwertszeit von 3,742 Jahren überwiegend unter Aussendung von Positronen zu 102Ru zerfällt. Zu einem geringen Teil geht der metastabile Kern auch unter Isomerieübergang in 102Rh über.[17]
Eine Anwendung als Tracer hat der mit einer Halbwertszeit von 35,88 Stunden kurzlebige Kern 105Rh gefunden.
Verwendung
Wie andere Platinmetalle wirkt Rhodium in vielen Prozessen katalytisch. Sowohl das Metall, als auch seine Verbindungen und Legierungen mit anderen Platinmetallen werden daher dementsprechend eingesetzt. Daneben existieren weitere rhodiumspezifische Anwendungsmöglichkeiten, die Verwendung ist jedoch durch den hohen Preis begrenzt.
Die wichtigsten Anwendungsbereiche des Rhodiums sind Fahrzeugkatalysatoren. Es dient darin als Katalysator zur Reduktion von Stickstoffmonoxid zu elementarem Stickstoff. Würde stattdessen Platin oder Palladium eingesetzt, würden verstärkt Ammoniak und Distickstoffmonoxid entstehen.[18]
Ein Teil des Rhodiums wird in Katalysatoren zur Salpetersäureherstellung verwendet. Im sogenannten Ostwald-Verfahren werden zur katalytischen Ammoniakverbrennung zu Stickstoffmonoxid Netze eingesetzt, die aus einer Platin-Rhodiumlegierung mit etwa 10 % Rhodium bestehen. Durch den Einsatz von Rhodium erhöht sich die Haltbarkeit und Ausbeute im Vergleich zu reinem Platin.[19] Auch im Andrussow-Verfahren zur Blausäure-Herstellung wird eine Rhodium-Platin-Legierung als Katalysator eingesetzt.[12]
Metallisches Rhodium kann als Beschichtung eingesetzt werden. Mit Rhodium beschichtete Flächen besitzen ein hohes Reflexionsvermögen und sind daher als hochwertige Spiegel geeignet. Gleichzeitig sind diese Beschichtungen sehr hart und chemisch stabil. Auch als Überzug für Schmuck, Brillengestelle oder Uhren wird Rhodium verwendet. Es verhindert das Anlaufen des verwendeten Metalls. Dies ist vor allem bei Schmuck aus Silber oder Weißgold wichtig. Der Vorgang des Überziehens wird Rhodinieren genannt.
Weitere mögliche Anwendungen sind hochbeanspruchte Laborgeräte, Heizspiralen oder Thermoelemente, die aus Platin-Rhodium-Legierungen gefertigt werden.
Sicherheitshinweise
Kompaktes Rhodium ist auf Grund der geringen Reaktivität ungefährlich, als feinverteiltes Pulver dagegen ist es leicht entzündlich und brennbar. Da brennendes Rhodium mit Wasser reagiert, dürfen zur Löschung nur Metallbrandlöscher (Klasse D) eingesetzt werden.[7] Wegen einiger Hinweise auf eine karzinogene Wirkung werden Rhodium und seine Verbindungen in die Kanzerogenitäts-Kategorie 3b eingeordnet.[7]
Wie andere Schwermetallionen sind gelöste Rhodiumionen in hohen Konzentrationen toxisch. In einer Untersuchung mit Lungenepithelzellen wurde ein LC50-Wert von 1,2 mmol · l−1 für Rhodium(III)-ionen ermittelt.[20]
Verbindungen
Rhodium bildet Verbindungen in den Oxidationsstufen von −I bis +VI. Die stabilste Stufe ist +III, höhere kommen vor allem in Verbindungen mit Fluor, niedrigere in Komplexen mit Liganden wie Kohlenstoffmonoxid, Cyanid oder Phosphanen vor.
Einige Rhodium-Verbindungen, beispielsweise Rhodium(II)-carboxykomplexe[21], werden untersucht, ob sie sich zur Behandlung von Krebs eignen. Die Verbindungen sind dabei, wie die des Platins auch, sehr oft nierentoxisch.[22][23]
Komplexe
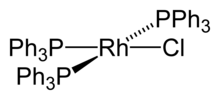
Einige Rhodiumkomplexe werden in technisch wichtigen Synthesen organischer Chemikalien als Katalysator eingesetzt. Dazu zählt der Wilkinson-Katalysator, ein quadratisch-planarer Rhodiumkomplex mit drei Triphenylphosphan (PPh3)- und einem Chlorid- Liganden. Eine Reaktion, die dieser Komplex katalysiert, ist die Hydrierung von Alkenen mit Wasserstoff. Es ist auch möglich, die Liganden durch chirale Gruppen zu ersetzen und so eine asymmetrische Hydrierung zu erreichen. Dies wird unter anderem für die Synthese der Aminosäure L-DOPA genutzt.[24] Eine weitere wichtige Reaktion, bei der der Wilkinson-Katalysator eingesetzt wird, ist die Hydroformylierung. Dabei werden aus Alkenen, Kohlenstoffmonoxid und Wasserstoff Aldehyde dargestellt.[25]
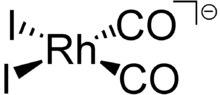
Ein weiterer Rhodiumkomplex wird zur Herstellung von Essigsäure eingesetzt. Im Monsanto-Prozess wird cis-[(CO)2RhI2]−, ein quadratisch-planarer Komplex mit zwei Kohlenstoffmonoxid- und zwei Iodid-Liganden eingesetzt.[25]
Halogenverbindungen
Mit den Halogenen Fluor, Chlor, Brom und Iod sind eine Reihe Verbindungen bekannt. Während Chlor, Brom und Iod nur Verbindungen in der Oxidationsstufe +III bilden, sind die Fluoride Rhodium(IV)-fluorid, Rhodium(V)-fluorid und Rhodium(VI)-fluorid bekannt. Die wichtigste Rhodium-Halogenverbindung ist Rhodium(III)-chlorid, die als Katalysator bei Reduktionen, Polymerisationen oder Isomerisierungen eingesetzt werden kann.[26]
Weitere Verbindungen
Es sind insgesamt drei Rhodiumoxide, Rhodium(III)-oxid Rh2O3, Rhodium(IV)-oxid RhO2 und Rhodium(VI)-oxid RhO3 bekannt. Letzteres ist allerdings nur in der Gasphase zwischen 850 °C und 1050 °C stabil. Rhodium(III)-oxid entsteht in wasserfreier Form durch Verbrennung aus den Elementen bei 600 °C. Erhitzt man dieses unter erhöhtem Sauerstoffdruck weiter, entsteht Rhodium(IV)-oxid.
Rhodiumsulfat Rh2(SO4)3 ist ein Zwischenprodukt bei der Rhodiumproduktion. Daneben wird es als Rohstoff für die galvanische Beschichtung von Oberflächen, beispielsweise bei Schmuckwaren, verwendet.
Rhodium(II)-acetat wird in der Organischen Chemie als Katalysator verwendet. Es bildet mit Diazoverbindungen, die eine benachbarte Carbonylgruppe besitzen, Carbene. Aus den Carbenen können unter anderem Cyclopropane dargestellt werden. Auch für die Gewinnung von Yliden und für Insertionsreaktionen können Rhodium-Carbene eingesetzt werden.[27]
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Rhodium) entnommen.
- ↑ N. N. Greenwood und A. Earnshaw: Chemie der Elemente, 1. Auflage, 1988, S. 1427, ISBN 3-527-26169-9.
- ↑ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009; Section 4, Properties of the Elements and Inorganic Compounds, p. 4-135.
- ↑ a b Datenblatt Rhodium bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ a b c Eintrag zu Rhodium (nur Pulver; komp. Metall ohne R-/S-Sätze) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. April 2008 (JavaScript erforderlich)
- ↑ James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie, 3. Auflage, de Gruyter, Berlin 2003, ISBN 3-11-017903-2.
- ↑ a b W. P. Griffith: Bicentenary of Four Platinum Group Metals, Part I Rhodium und Palladium. In: Platinum Metals Review, 2003, 47 (4), S. 175–183.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009; Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea, p. 14-18.
- ↑ Rhodium in: Anthony et al.: Handbook of Mineralogy, 1990, 1, S. 101 (pdf).
- ↑ a b c Hermann Renner et al.: Platinum Group Metals and Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a21_075.
- ↑ Bundesanstalt für Geowissenschaften und Rohstoffe: Rohstoffwirtschaftliche Steckbriefe für Metall- und Nichtmetallrohstoffe, Stand Januar 2007 (pdf).
- ↑ a b historische Rhodiumpreise bei kitco.com.
- ↑ Am 19. Juni 2008 wurde Rhodium sogar bis zu 10.200 US Dollar gehandelt (etwa 6.580,00 Euro) bevor es dann bis November 2008 auf 1.100 US Dollar zurueckfiel. [1] Bundesanstalt für Geowissenschaften und Rohstoffe: Rohstoffpreise, Stand Juni 2008.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica, 1974, B30, S. 193–204.
- ↑ a b G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics, 2003, Bd. A 729, S. 3–128.
- ↑ Martin Votsmeier, Thomas Kreuzer und Gerhard Lepperhoff: Automobile Exhaust Control. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2003, doi:10.1002/14356007.a03_189.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1697.
- ↑ Bernd Sures, Sonja Zimmermann: Untersuchungen zur Toxizität von Platin, Palladium und Rhodium. Programm Lebensgrundlage Umwelt und ihre Sicherung, Universität Karlsruhe, 2005, pdf.
- ↑ Esther B. Royar, Stephen D. Robinson: Rhodium(II)-Carboxylato Complexes. In: Platinum Metals Rev., 1982, 26 (2), S. 65–69; pdf.
- ↑ B. Desoize: Metals and metal compounds in cancer treatment. In: Anticancer Res 24/2004, S. 1529–1544; PMID 15274320.
- ↑ N. Katsaros, A. Anagnostopoulou: Rhodium and its compounds as potential agents in cancer treatment. In: Critical Reviews in Oncology/Hematology 42, 2002, S. 297–308; PMID 12050021.
- ↑ William S. Knowles: Asymmetrische Hydrierungen (Nobel-Vortrag). In: Angew. Chem., 114, 12, S. 2096–2107, doi:10.1002/1521-3757(20020617)114:12<2096::AID-ANGE2096>3.0.CO;2-Z.
- ↑ a b Christoph Elschenbroich: Organometallchemie. 5. Auflage, Teubner Wiesbaden 2005, ISBN 3-519-53501-7.
- ↑ Rhodiumverbindungen in: Roempp Chemie Lexikon, Thieme Verlag, 2008.
- ↑ Tao Ye, M. Anthony McKervey: Organic Synthesis with α-Diazocarbonyl Compounds. In: Chem. Rev. 1994, 94, S. 1091–1160, doi:10.1021/cr00028a010.
Literatur
- Rhodium in: Roempp Chemie Lexikon, Thieme Verlag, 2008.
- William Hyde Wollaston: On a New Metal, Found in Crude Platina. Phil. Trans. R. Soc. Lond. January 1, 1804, 94, S. 419–430; doi:10.1098/rstl.1804.0019 (Volltext)
- William Hyde Wollaston: On the Discovery of Palladium; With Observations on Other Substances Found with Platina. Phil. Trans. R. Soc. Lond. January 1, 1805, 95, S. 316–330; doi:10.1098/rstl.1805.0024 (Volltext)
Weblinks
 Commons: Rhodium – Album mit Bildern und/oder Videos und Audiodateien
Commons: Rhodium – Album mit Bildern und/oder Videos und Audiodateien Wiktionary: Rhodium – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Rhodium – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase 
Dieser Artikel wurde am 28. August 2008 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. Kategorien:- Feuergefährlicher Stoff
- Gruppe-9-Element
- Übergangsmetall
- Periode-5-Element
- Chemisches Element
- Wikipedia:Lesenswert
- Katalysator
- Mineral
- Kubisches Kristallsystem
- Elemente (Mineralklasse)
- Elektrotechnischer Werkstoff
Wikimedia Foundation.