- Selensäure
-
Strukturformel 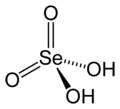
Allgemeines Name Selensäure Summenformel H2SeO4 CAS-Nummer 7783-08-6 Kurzbeschreibung farblose hexagonale Prismen[1]
Eigenschaften Molare Masse 144,97 g·mol−1 Aggregatzustand fest
Dichte 2,95 g·cm−3[2]
Schmelzpunkt Siedepunkt 260 °C[2]
pKs-Wert 1,74 (pKs2)[3]
Löslichkeit gut in Wasser[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 


Gefahr
H- und P-Sätze H: 331-301-373-400-410 EUH: keine EUH-Sätze P: 260-261-301+310-321-405-501 [2] EU-Gefahrstoffkennzeichnung [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23/25-33-50/53 S: (1/2)-20/21-28-45-60-61 MAK 0,05 mg·m−3[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Selensäure ist eine starke (ähnlich wie Schwefelsäure) anorganische Säure mit der Summenformel H2SeO4. In wässriger Lösung liegt sie weitgehend dissoziiert vor und bildet eine klare, farblose Flüssigkeit. Die Selensäure wurde von Eilhard Mitscherlich 1827 in Deutschland entdeckt. Ihre Salze heißen Selenate.
Gewinnung
Die Selensäure kann auf verschiedene Arten dargestellt werden.
Eine Möglichkeit ist die Oxidation von Seleniger Säure (H2SeO3) oder Selen(IV)-oxid mit Wasserstoffperoxid (H2O2), Kaliumpermanganat (KMnO4) oder Chlorsäure (HClO3):[4]
In der Regel wird jedoch elementares Selen mit Chlor- oder Bromwasser oxidiert:
Eigenschaften
Reine Selensäure bildet farblose Kristalle, die bei etwa 60 °C schmelzen.
Selensäure hat chemisch gesehen große Ähnlichkeit mit der Schwefelsäure, wirkt jedoch bedeutend stärker oxidierend (Standardpotential in saurer Lösung für die Reduktion zu Seleniger Säure: + 1,15 V[3]). Sie ist eine starke Säure und wirkt hygroskopisch. Dies bedeutet, dass sie, ebenso wie konzentrierte Schwefelsäure, organische Substanzen durch Wasserentzug verkohlt. Selensäure ist wie Königswasser in der Lage, Gold zu lösen:
Einzelnachweise
- ↑ Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 7783-08-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11.01.08 (JavaScript erforderlich).
- ↑ a b A.F.Holleman, E.Wiberg. Lehrbuch der Anorganischen Chemie. Walter de Gruyter & Co. Berlin 1995, 101. Auflage, ISBN 3-11-012641-9.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 432-3.
Kategorien:- Giftiger Stoff
- Umweltgefährlicher Stoff
- Anorganische Säure
- Selenverbindung
Wikimedia Foundation.





