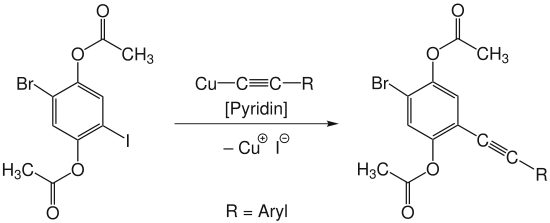
- Stephens-Castro-Kupplung
-
Die Stephens-Castro-Kupplung ist eine organisch-chemische Namensreaktion. Die Reaktion wurde 1963 von den Chemikern Castro und Stephens entdeckt.[1] [2]. Sie entwickelte sich bis heute zu einem wichtigen Synthesewerkzeug in der organischen Synthese und der kombinatorischen Synthese in der Medizinalchemie.
Die Reaktion ähnelt der Rosenmund-von Braun-Reaktion (1916), in der ein Arylhalogenid mit Kupfer(I)-cyanid zum Arylnitril reagiert. Die Sonogashira-Kupplung (1975), bei der das Kupferacetylid in situ hergestellt wird und die Kreuzkupplung mit einem Palladiumkatalysator durchgeführt wird, ist als Weiterentwicklung der Stephens-Castro-Kupplung anzusehen.
Die Stephens-Castro-Kupplung erfolgt durch Umsetzung des Kupferacetylides mit einem Arylhalogenid in Anwesenheit von Pyridin. Dabei entsteht durch Knüpfung einer Kohlenstoff-Kohlenstoff-Bindung ein aromatisches Alkin.
Inhaltsverzeichnis
Reaktionsmechanismus
Der Reaktionsverlauf geht vom terminalen Alkin aus. Dieses wird zuerst vom Kupfer(I)-Ion durch Bildung eines π-Komplexes assoziiert. Durch den dadurch entstandenen erheblichen Elektronenmangel am Alkin wird der pKa-Wert von ca. 30 auf unter 9 gesenkt. Durch diese Aktivierung kann das Alkin im Folgeschritt deprotoniert werden; hierzu wird Pyridin verwendet. Gleichzeitig bildet sich eine Kupfer(I)-organische Verbindung, an die das Aryliodid oxidativ addiert. Die dadurch gebildete, wenig stabile Kupfer(III)-Verbindung zerfällt in einem schnellen Folgeschritt durch reduktive Eliminierung zum Arylalkin und Kupfer(I)-iodid, das zur Assoziation eines neuen terminalen Alkins zur Verfügung steht. Auf diese Weise wird der Katalysator wieder hergestellt.
Nachteile
Der Nachteil der Stephens-Castro-Kupplung besteht in den stöchiometrisch anfallenden Mengen an Kupferacetyliden wodurch Explosionsgefahr besteht. Als weiterer Nachteil ist die Verwendung von siedendem Pyridin anzusehen. Aus diesen Gründen werden daher heutzutage die Sonogashira-Kupplung, die Stille-Kupplung oder ähnliche Reaktionen bevorzugt verwendet.
Literatur
- R. Brückner: Reaktionsmechanismen, 3. Auflage, Spektrum Akad. Verlag, München, 2004, S. 691. ISBN 3-8274-1579-9
Siehe auch
Einzelnachweise
- ↑ The Substitution of Aryl Iodides with Cuprous Acetylides. A Synthesis of Tolanes and Heterocyclics R. D. Stephens und C. E. Castro J. Org. Chem.; 28 (1963) 3313 - 3315, doi:10.1021/jo01047a008.
- ↑ D. C. Owsley und C. E. Castro.Organic Syntheses, Coll. Vol. 6 (1988) S. 916 ; Vol. 52 (1972) S. 128 Link.
Wikimedia Foundation.