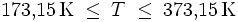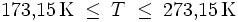- Sättigung (Flüssigkeiten)
-
Von Sättigung spricht man in der Physik und Chemie, wenn ein Stoff, Körper oder ein Feld eine solch große Menge eines anderen aufgenommen hat, dass eine weitere Aufnahme unter den gegebenen Bedingungen zu einem energetisch ungünstigeren Zustand führen würde.
Dieser ungünstigere Zustand kann sich bei stofflichen Systemen wie Lösungen, Schmelzen oder Gasen spontan abbauen, besonders beim Vorliegen der hierbei hilfreichen Kristallisations- (sog. Impfkristalle) oder Kondensationskeime. Bei deren Fehlen kann dieser Zustand jedoch auch längerfristig als Übersättigung bestehen bleiben.
Beim Magnetisieren tritt zum Beispiel Sättigung ein, wenn alle Elementarmagnete innerhalb eines Eisenkerns ausgerichtet sind, (vgl. Sättigungsmagnetisierung).
Sättigung von Flüssigkeiten
Ist in einer Flüssigkeit ein Stoff gelöst, so bezeichnet man diese als Lösungsmittel und das resultierende Gemisch als Lösung. Ist die höchstmögliche Menge des Stoffes im Lösungsmittel gelöst, so spricht man von einer gesättigten Lösung und bezeichnet die entsprechende Konzentration des Stoffes als Sättigungsmenge bzw. Sättigungskonzentration. Diese Sättigungsmenge ist dabei abhängig von der Art des Lösungsmittels und der Temperatur. Im Normalfall kann sie nicht überschritten werden, was bei einer zusätzlichen Stoffzugabe dessen Lösung verhindern würde. Eine Überschreitung dieser Grenze ist jedoch möglich, was man in der Folge als übersättigte Lösung bezeichnet. Entscheidend für das Auftreten einer Übersättigung ist hierbei die Existenz von Kristallisationskernen. Je weniger von ihnen vorliegen, desto stärker kann die Lösung übersättigt werden und umgekehrt.
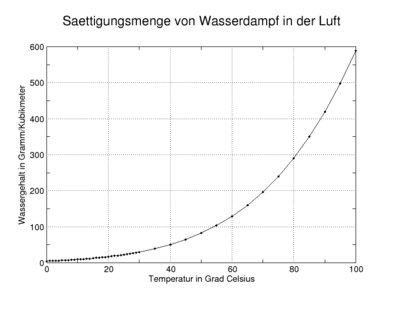
Sättigung von Gasen am Beispiel des Wasserdampfs
Wasserdampf ist dann gesättigt, wenn er nicht mehr fähig ist seine eigene Konzentration in der Luft weiter zu erhöhen, da diese schon die maximale Luftfeuchtigkeit mit sich trägt. Synonym verwendbare Begriffe für die Sättigung des Wasserdampfs sind:
- ein herrschendes thermodynamisches Gleichgewicht
- angeglichene chemische Potenziale von Wasserdampf und flüssigem Wasser
- 100% relative Luftfeuchte
- Taupunktdifferenz gleich Null bzw. Temperatur gleich dem Taupunkt
- Sättigungsdefizit gleich Null bzw. Dampfdruck gleich dem Sättigungsdampfdruck
Durch das Abkühlen der Luft unter den Taupunkt, ohne dass dabei Kondensation (Nebel, Wolke) eintritt, kommt es zu einer Übersättigung. Grund hierfür ist das Fehlen von Kondensationskeimen, also Aerosolen wie etwa Staub- oder Eispartikel. Da in der Regel jedoch meist Kondensationskeime vorhanden sind, treten in der Erdatmosphäre kaum Übersättigungen von mehr als einem Prozent auf. Die Tabelle weiter unten enthält einige beispielhafte Werte zur Sättigungsmenge des Wasserdampfs als Funktion der Temperatur aus D. Sonntag (1982). Es muss hierbei aufgrund der unterschiedlichen Werte des Sättigungsdampfdrucks unter einer Temperatur von 0°C danach unterschieden werden, ob eine Wasser- oder eine Eisoberfläche vorliegt. Man bezeichnet die Sättigungsmenge oder auch Sättigungskonzentration des Wasserdampfes ferner als maximale Luftfeuchte. Diese kann man mit folgenden Formeln berechnen:
Über Wasser:
Über Eis:
Die einzelnen Formelzeichen stehen für folgende Größen:
- rho w, max - Sättigung über Wasser [kg/m³]
- Ew - Sättigungsdampfdruck über Wasser [Pa]
- Ei - Sättigungsdampfdruck über Eis [Pa]
- Rw - individuelle Gaskonstante des Wassers = 461,52 J/(kg K)
- T - Temperatur [K]
Sättigungswerte der absoluten Luftfeuchte Temperatur in °C Sättigungsmenge über Wasser in g/m³ Sättigungsmenge über Eis in g/m³ -100 4,5436 · 10 − 5 1,7465 · 10 − 5 -95 1,1432 · 10 − 4 4,5752 · 10 − 5 -90 2,7247 · 10 − 4 1,1373 · 10 − 4 -85 6,1778 · 10 − 4 2,6939 · 10 − 4 -80 1,3378 · 10 − 3 6,1013 · 10 − 4 -75 2,7765 · 10 − 3 1,3260 · 10 − 3 -70 5,5406 · 10 − 3 2,7735 · 10 − 3 -65 0,010661 0,005598 -60 0,019832 0,010930 -55 0,035750 0,020692 -50 0,062584 0,038056 -45 0,10661 0,068124 -40 0,17702 0,11890 -35 0,28700 0,20265 -30 0,45501 0,33776 -25 0,70640 0,55127 -20 1,0753 0,88211 -15 1,6068 1,3854 -10 2,3596 2,1380 -5 3,4086 3,2449 -4 3,6619 3,5205 -3 3,9316 3,8172 -2 4,2187 4,1363 -1 4,5239 4,4794 0 4,84843 4,84795 1 5,19317 - 2 5,55921 - 3 5,94766 - 4 6,35967 - 5 6,79642 - 6 7,25917 - 7 7,74919 - 8 8,26783 - 9 8,81648 - 10 9,39658 - 11 10,0096 - 12 10,6572 - 13 11,3408 - 14 12,0623 - 15 12,8232 - 16 13,6254 - 17 14,4707 - 18 15,3611 - 19 16,2984 - 20 17,2848 - 21 18,3224 - 22 19,4132 - 23 20,5596 - 24 21,7638 - 25 23,0283 - 26 24,3554 - 27 25,7477 - 28 27,2079 - 29 28,7385 - 30 30,3424 - 35 39,5623 - 40 51,0726 - 45 65,3114 - 50 82,7730 - 55 104,011 - 60 129,642 - 65 160,344 - 70 196,863 - 75 240,011 - 80 290,669 - 85 349,782 - 90 418,369 - 95 497,511 - 100 588,359 - In Anwendungen wie Bauphysik, Trocknung, Meteorologie wird anstelle der Sättigungsmenge zumeist der in obigen Formeln auftretende Sättigungsdampfdruck als Maß für die maximale Luftfeuchte verwendet – vgl. Feuchtemaße. Die Formeln beruhen auf der allgemeinen Gasgleichung (vgl. Dampfdruck).
Quellen und Referenzen
Weblinks
Online-Rechner für die wichtigsten meteorologischen Größen
Literatur
D. Sonntag, D. Heinze: Sättigungsdampfdruck- und Sättigungsdampfdichtetafeln für Wasser und Eis. 1. Aufl., VEB Deutscher Verlag für Grundstoffindustrie, 1982
Wikimedia Foundation.