- Tavanic
-
Strukturformel 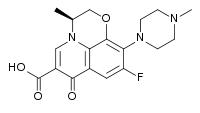
Allgemeines Freiname Levofloxacin Andere Namen Summenformel C18H20FN3O4 CAS-Nummer 100986-85-4 PubChem 149096 ATC-Code DrugBank APRD00477 Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Hemmung des den Bakterien eigenen Enzyms DNA-Gyrase
Fertigpräparate - Tavanic® (CH)
- Oftaquix® (D)
- Tavanic® (A)
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 361,37 g·mol−1 Aggregatzustand Leicht gelbliches Pulver [1]
Schmelzpunkt Sicherheitshinweise Gefahrstoffkennzeichnung [1]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 22-42/43-68 S: 26-36/37/39 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 WGK 3 (stark wassergefährdend) [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Levofloxacin ist eines der Fluorchinolon-Antibiotika fortgeschrittenerer Generation. Es wird in Europa von Sanofi-Aventis unter dem Markennamen Tavanic® vertrieben, in den Vereinigten Staaten von Ortho-McNeil als Levaquin®, in Chile als Gatigol® der Firma Alpes Selection, und in Asien von der Firma Daiichi Sankyo K.K. unter dem Markennamen Cravit®.
Levofloxacin wurde in Japan 1993 freigegeben, in den USA wurde die Registrierung durch die FDA in 1996 erteilt.[2] Levofloxacin ist das (S)-Enantiomer (L-Isomer) von Ofloxacin (ein Racemat) und hat in etwa die doppelte Wirksamkeit von Ofloxacin. Die Verwendung von (enantiomerenreinem) Levofloxacin ist der Verwendung von (racemischen) Ofloxacin vorzuziehen, da das im Ofloxacin zu 50% enthaltene D-Isomer bestenfalls unwirksam ist. Levofloxacin wirkt wie andere Fluorchinolone als Inhibitor des Enzyms Gyrase, welches für DNA-Supercoiling in Bakterien während deren Vermehrungszyklus verantwortlich ist.
Wie bei allen Fluorchinolonen treten auch bei Levofloxacin zuweilen unerwünschte Wirkungen auf. So kann es zur Achillessehnenruptur kommen. Dies betrifft eher ältere Personen und Patienten, die Corticoide einnehmen. Erklärt wird das mit einer erhöhten Expression von Matrixmetalloproteinasen, die die Festigkeit der Sehnen vermindern.[3][4]
Die vielstufige Synthese von Levofloxacin ist in der Literatur[5] beschrieben.
Einzelnachweise
- ↑ a b c d e Sicherheitsdatenblatt für Levofloxacin – Sigma-Aldrich 30.12.2007
- ↑ http://www.accessdata.fda.gov/scripts/cder/ob/docs/obdetail.cfm?Appl_No=020634&TABLE1=OB_Rx
- ↑ Vyas et al. Quinolone-associated rupture of the Achilles' tendon. New England Journal of Medicine 2007; 357 (20): 2067.
- ↑ McGarvey et al. Partial Achilles tendon ruptures associated with fluoroquinolone antibiotics: a case report and literature review. Foot Ankle Int. 1996 Aug;17(8):496-8. PMID 8863030
- ↑ Pharmaceutical Substances, Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dieter Reichert, 4. Auflage (2000) 2 Bände erschienen im Thieme-Verlag Stuttgart, siehe dort Seiten 1165 – 1168, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
Wikimedia Foundation.
