Teilladung — Teil|la|dung: svw. Partialladung … Universal-Lexikon
Teilladungsverkehr — Als Teilladungsverkehre werden Transporte bezeichnet, bei denen mehrere Teilladungen zusammengefasst und auf einem Transportmittel befördert werden. Als Teilladung bezeichnet man Sendungen, die aufgrund ihrer Größe oder entsprechender Vorgaben… … Deutsch Wikipedia
Bindungspolarität — Polare Atombindungen sind chemische Bindungen, bei denen die beteiligten Atome infolge ihrer unterschiedlichen Elektronegativität Teilladungen tragen. Die Differenz ist jedoch nicht groß genug, dass eine reine Ionenbindung entsteht. Das Atom mit… … Deutsch Wikipedia
Delta-EN — Abschätzung des prozentualen Ionenbindungsanteils in Abhängigkeit von der Elektronegativitätsdifferenz Die Elektronegativitätsdifferenz (im Labor Jargon auch Delta EN (ΔEN) genannt) ist in einer Bindung die Differenz der Elektronegativitäten der… … Deutsch Wikipedia
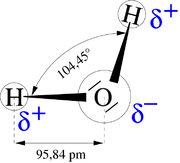
Elektrisches Dipolmoment — Dipolmoment eines H2O Moleküls. rot: negative Teilladung blau: positive Teilladung grün: gerichteter Dipol Das elektrische Dipolmoment charakterisiert eine räumliche Ladungstrennung. Hat man in einem Körper, z. B. einem Molekül, an… … Deutsch Wikipedia
Elektronegativitätsdifferenz — Abschätzung des prozentualen Ionenbindungsanteils in Abhängigkeit von der Elektronegativitätsdifferenz Die Elektronegativitätsdifferenz (im Laborjargon auch Delta EN (ΔEN) genannt) ist in einer Bindung die Differenz der Elektronegativitäten der… … Deutsch Wikipedia
Mikrowellenherd — Ein Mikrowellenherd oder auch Mikrowellenofen, Mikrowellengerät (kurz: Mikrowelle), ist ein Gerät zum schnellen Erwärmen von Speisen, Flüssigkeiten und anderen geeigneten Stoffen. Seine Wirkung beruht auf der Absorption von Dezimeterwellen… … Deutsch Wikipedia
Orientierungspolarisation — Dipolmoment eines H2O Moleküls. rot: negative Teilladung blau: positive Teilladung grün: gerichteter Dipol Als Orientierungspolarisation bezeichnet man die durch Ausrichtung permanenter elektrischer Dipole (z. B. Wasser) in einem… … Deutsch Wikipedia
Polare Atombindung — Polare Atombindungen sind chemische Bindungen, bei denen die beteiligten Atome infolge ihrer unterschiedlichen Elektronegativität Teilladungen tragen.[1] Die Differenz ist jedoch nicht groß genug, dass eine reine Ionenbindung entsteht. Das Atom… … Deutsch Wikipedia
Polare Bindung — Polare Atombindungen sind chemische Bindungen, bei denen die beteiligten Atome infolge ihrer unterschiedlichen Elektronegativität Teilladungen tragen. Die Differenz ist jedoch nicht groß genug, dass eine reine Ionenbindung entsteht. Das Atom mit… … Deutsch Wikipedia