- Tellursäure
-
Strukturformel 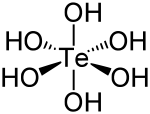
Allgemeines Name Tellursäure Andere Namen Orthotellursäure
Summenformel H6O6Te CAS-Nummer 7803-68-1 PubChem 62686 Kurzbeschreibung farbloses Pulver[1]
Eigenschaften Molare Masse 229,66 g·mol−1 Aggregatzustand fest
Dichte 3,16 g·cm−3 [2]
Schmelzpunkt pKs-Wert 7,70 (pKs1); 10,95 (pKs2)[4]
Löslichkeit mäßig in Wasser (100 g·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 332 EUH: keine EUH-Sätze P: keine P-Sätze [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20 S: 22-36/37/39-38 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tellursäure ist eine im Gegensatz zur Schwefelsäure sehr schwache Säure des Tellurs. Die wesentlich geringere Acidität ist auf die unterschiedliche Struktur zurückzuführen - im Gegensatz zur Schwefelsäure kann die negative Ladung im Anion nicht delokalisiert werden.
Sie bildet farblose und wasserlösliche Kristalle. Da bereits die 1. Dissoziationsstufe von Tellursäure sehr klein ist und die letzte (6.) demnach verschwindend klein, existieren die meisten Tellurate (Salze) nur als Hydrogentellurate, jedoch existiert Silbertellurat, Ag6TeO6. Das Anhydrid der Tellursäure, Tellurtrioxid (TeO3), ist ein gelbes Kristallpulver. Tellursäure und (wasserlösliche) Tellurate sind giftig und wirken oxidierend.
Herstellung
Tellursäure enthält man aus feinverteiltem Tellur und wäßriger Chlorsäure-Lösung, durch Oxidation von Tellurdioxid mit Kaliumpermanganat in Salpetersäure, durch Oxidation von Tellur oder Tellurdioxid mit Wasserstoffperoxid oder durch Oxidation von Tellur mit Salpetersäure und Chromtrioxid.[5]
Einzelnachweise
- ↑ a b c d e Datenblatt Telluric acid bei Sigma-Aldrich, abgerufen am 23. April 2011.
- ↑ D'Ans-Lax: Taschenbuch für Chemiker und Physiker, 4. Auflage, Band 2, Springer Verlag 1982, ISBN 3-540-12263-X.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, 101. Auflage, de Gruyter Verlag 1995, ISBN 3-11-012641-9.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 451-3.
Kategorien:- Gesundheitsschädlicher Stoff
- Anorganische Säure
- Tellurverbindung
Wikimedia Foundation.
