- Thermodynamisches Potential
-
Ausgehend von der Fundamentalgleichung der Thermodynamik, die die innere Energie U als Funktion aller extensiven Variablen ausdrückt, besteht die Möglichkeit, andere, vom Informationsgehalt gleichwertige Funktionen – die thermodynamischen Potentiale – als Funktion ihrer natürlichen Variablen anzugeben. Die dazu notwendige Koordinatentransformation ist die Legendre-Transformation, die von den extensiven Variablen zu deren Ableitungen übergeht. Die Ableitungen der inneren Energie nach den extensiven Variablen sind jedoch die intensiven. Je nach äußeren Bedingungen, d.h. je nachdem welche intensive Größe kontrolliert werden kann, wird das zugehörige Potential definiert.
Inhaltsverzeichnis
Beschreibung
Die innere Energie U(S,V,N) und alle aus ihr mittels Legendre-Transformation hervorgehenden Funktionen sind thermodynamische Potentiale. Die Legendre-Transformation transformiert die Potentiale von Entropie S nach Temperatur T, Volumen V nach Druck p und Teilchenzahl N nach chemisches Potential μ. Es gibt somit 3 Variablenpaare (S,T),(V,p),(N,μ) und daher 23 = 8 thermodynamische Potentiale.
Die bekanntesten und gebräuchlichsten sind (jeweils als Funktion ihrer natürlichen Variablen ausgedrückt):
- Innere Energie U = U(S,V,N)
- Freie Energie (auch Helmholtz-Potential) F = F(T,V,N)
- Enthalpie H = H(S,p,N)
- Gibbs-Energie (auch Freie Enthalpie) G = G(T,p,N)
- Großkanonisches Potential Ω = Ω(T,V,μ)
Die verbleibenden drei Potentiale:
- R = R(S,V,μ)
- J = J(S,p,μ)
- K = K(T,p,μ)
Beziehungen zwischen den Potentialen
Diese thermodynamischen Potentiale stehen über die sogenannten charakteristischen Funktionen miteinander in Zusammenhang:
- H = U + pV
- F = U − TS
- G = H − ST
- Ω = F − μN
- R = U − μN
- J = R + pV
- K = G − μN
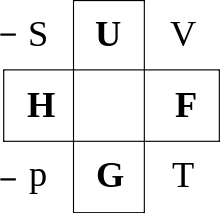
Eine Möglichkeit sich die thermodynamischen Potentiale mit ihren natürlichen Variablen zu merken, ist das Guggenheim-Quadrat.
Physikalische Bedeutung
Die Bedeutung der thermodynamischen Potentiale besteht darin, dass sie die Gleichgewichtsbedingung anzeigen. Bei Anschluss eines Systems an ein anderes stellt sich das thermodynamische Gleichgewicht dann ein – die Entropie des Gesamtsystems ist dann maximal, wenn alle intensiven Parameter gleich sind. Dies, so kann man einfach zeigen, entspricht immer einem Extremalprinzip bei dem zugehörigen thermodynamischen Potential. In der Praxis bedeutet das: Sind S, V und N die veränderlichen Variablen eines Systems (alle anderen seien mittels Zwangsbedingungen festgelegt), so liefert die Innere Energie die vollständige Information über das System und sie wird sich gleichgewichtig einstellen. Sind, wie bei chemischen Reaktionen, p, T und N die freien Parameter, so liefert die Freie Enthalpie die korrekte Beschreibung, u.s.w.
Beispiel für Transformation
Exemplarisch soll der Wechsel von einem Potential zum anderen mittels totalen Differentialen durchgeführt werden. Wir beginnen bei der Inneren Energie:
Ziel ist von der Inneren Energie mit den natürlichen Variablen S,V,N auf ein neues Potential mit den natürlichen Variablen T,V,N zu transformieren. Dazu schreibe
 als
als 
Nun bringe d(TS) auf die linke Seite:
Das neue Potential U − TS hängt nun von den natürlichen Variablen T,V,N ab und wird Freie Energie F genannt.
Literatur
- Callen: Thermodynamics and an Introduction to Thermostatistics. Wiley & Sons. ISBN 978-0471862567
- Ulrich Nickel, Lehrbuch der Thermodynamik. Eine verständliche Einführung. 2. Auflage. PhysChem, 2011, ISBN 978-3-937744-06-3
Wikimedia Foundation.