- Triosephosphatisomerase
-
Triosephosphatisomerase —
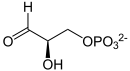
Vorhandene Strukturdaten: 1HTI, 1wyi, 2jk2, 2vom Masse/Länge Primärstruktur 248 Aminosäuren Sekundär- bis Quartärstruktur Homodimer Isoformen 2 Bezeichner Gen-Name TPI1 Externe IDs OMIM: 109450 UniProt: P60174 CAS-Nummer: 9023-78-3 Enzymklassifikation EC, Kategorie 5.3.1.1 Isomerase Substrat D-Glycerinaldehyd-3-Phosphat Produkte Dihydroxyacetonphosphat (=Glyceronphosphat) Vorkommen Homologie-Familie TPI Übergeordnetes Taxon Chordatiere Die Triosephosphatisomerase (TIM, TPI) ist das Enzym, das Dihydroxyacetonphosphat (DHAP) zu Glycerinaldehyd-3-Phosphat (GAP) umwandelt. Dies ist ein Teilschritt der Glycolyse. TPI ist damit unverzichtbar für alle Lebewesen, die Glukose oder Fructose nur mittels Glycolyse verwerten können.
Im Menschen kodiert ein Gen (TPI1) auf Chromosom 12, Locus 12p13 das funktionelle Protein, mindestens drei Pseudogene sind bekannt. Mutationen am Gen können Triosephosphat-Isomerase-Defizienz verursachen.
Ein potenter Inhibitor ist 2-Phosphoglycolat, was in Pflanzen im Zuge der Photorespiration abgebaut wird.[1]
Katalysiertes Gleichgewicht
TPI stellt ein Gleichgewicht zwischen den Zwischenprodukten Dihydroxyacetonphosphat (DHAP) und Glycerinaldehyd-3-Phosphat (GAP) her. Die Substrate entstehen aus Fructose-1,6-Bisphosphat in der vorgelagerten Aldolase-Reaktion. Das Gleichgewicht liegt stark auf der Seite des DHAP, für den Fortlauf der Glykolyse wird allerdings GAP benötigt, so dass sich das Gleichgewicht durch Produktentnahme verschiebt (Prinzip von Le Chatelier).
Die Katalyse erfolgt über ein Endiol- bzw. Endiolat-Intermediat. Hierbei tritt ein Glutamat-Rest (Glu165) im aktiven Zentrum des Enzyms mit dem ungewöhnlich hohen pKs-Wert von 6,5 als Base auf, ein Histidin-Rest (His95) als Säure.
Die Umsetzung von GAP zu DHAP erfordert einen ausgefallenen Reaktionsmechanismus, in dessen Verlauf Glu165 ein H+-Ion vom C-Atom 2 abstrahiert, während His95 ein H+-Ion ans C1-Atom abgibt. Dieser Mechanismus kann, da die Carboxygruppe des Glu viel azider (saurer) als das C2-Atom ist, unter nicht-enzymatischen Bedingungen keinesfalls ablaufen. Die TIM bildet durch die ideal auf das Substrat angelegte Umgebung des aktiven Zentrums hingegen sog. Low Barrier Hydrogen Bonds (LBHB) aus, eine spezielle Art von Wasserstoff-Brücken, die mit -40 bis -80 KJ/mol (anstatt etwa -12 bis -30 KJ/mol) deutlich stabiler sind. Diese LBHB werden durch gleichzeitige Protonierung und Deprotonierung an den C-Atomen C1 bzw. C2 erreicht.
Eine 10 Aminosäuren lange Sequenz des Enzyms, ein sogenannter Loop, verdeckt das aktive Zentrum im substratbeladenen Zustand. Einerseits wird damit das Endiol-Zwischenprodukt stabilisiert und die katalytische Aktivität auf diese Weise um den Faktor 105 erhöht, andererseits wird ein Entweichen dieses Zwischenprodukts verhindert - das Endiolphosphat würde spontan dephosphorylieren und sich zum toxischen Methylglyoxal umlagern.
Die TIM gilt als sog. "perfektes Enzym". Dies bedeutet, dass Veränderungen am Enzym, gleich welcher Art, keine Umsatzsteigerung mehr herbeizuführen vermögen: Die Wechselzahl von 4300 Substratmolekülumsätzen pro Sekunde wird nur durch die Diffusionsgeschwindigkeiten von Substrat und Produkt begrenzt.
Einzelnachweise
- ↑ Anderson, LE. (1971): Chloroplast and cytoplasmic enzymes. II. Pea leaf triose phosphate isomerases. In: Biochim Biophys Acta. 235(1); 237–244; PMID 5089710; doi:10.1016/0005-2744(71)90051-9
Weblinks
 Wikibooks: Biochemie und Pathobiochemie: Triosephosphat-Isomerase – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Triosephosphat-Isomerase – Lern- und Lehrmaterialien Wikibooks: Biochemie und Pathobiochemie: Triacylglycerinbiosynthese – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Triacylglycerinbiosynthese – Lern- und Lehrmaterialien Wikibooks: Biochemie und Pathobiochemie: D-Glycerinaldehyd-3-phosphat – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: D-Glycerinaldehyd-3-phosphat – Lern- und Lehrmaterialien
Wikimedia Foundation.