- Histidin
-
Strukturformel 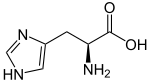
L-Histidin (links) und D-Histidin (rechts) Allgemeines Name Histidin Andere Namen - (2S)-(−)-Histidin
- L-Histidin
- (R)-(+)-Histidin
- D-Histidin
- (S)-2-Amino-3-(1H-imidazol-4-yl) propansäure
- Imidazolalanin
- Abkürzungen:
- His (Dreibuchstabencode)
- H (Einbuchstabencode)
Summenformel C6H9N3O2 CAS-Nummer - 71-00-1 (L-Enantiomer)
- 351-50-8 (D-Enantiomer)
PubChem 6274 ATC-Code V06DE00
DrugBank DB00117 Kurzbeschreibung farblose Kristalle[1]
Eigenschaften Molare Masse 155,16 g·mol−1 Aggregatzustand fest
Schmelzpunkt pKs-Wert Löslichkeit schlecht in Wasser (38,2 g·l−1 bei 20 °C)[3]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [3] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 5110 mg·kg−1 (Ratte, oral)[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Histidin, abgekürzt His oder H, ist in seiner natürlichen L-Form eine semi-essentielle proteinogene α-Aminosäure.
Gemeinsam mit Arginin und Lysin zählt sie zu den basischen Aminosäuren oder Hexonbasen, zusammen mit Phenylalanin, Tyrosin und Tryptophan zu den aromatischen Aminosäuren. Basische Aminosäuren besitzen zusätzlich zur obligatorischen α-Aminogruppe eine weitere basische Gruppe. Im Histidin ist dies der Imidazolring, der gleichzeitig die Aromatizität des Histidins bedingt[4].
In diesem Artikel betreffen die Angaben zur Physiologie allein die L-Histidin [Synonym: (S)-Histidin]. Wenn in diesem Artikel und in der wissenschaftlichen Literatur ohne jeden Zusatz „Histidin“ erwähnt wird, ist stets L-Histidin gemeint. Racemisches DL-Histidin [Synonym: (RS)-Histidin] und enantiomerenreines D-Histidin [Synonym: (R)-Histidin] sind synthetisch zugänglich und besitzen nur geringe praktische Bedeutung. Die Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung für fossiles Knochenmaterial – herangezogen werden.[5]
Inhaltsverzeichnis
Eigenschaften
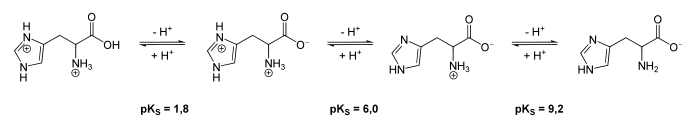
Der Imidazolring unterliegt einer Tautomerie, genauer einer Imin-Enamin-Tautomerie. Das Wasserstoffatom, das an eins der Stickstoffatome des Rings gebunden ist, kann zum anderen Stickstoffatom wechseln. Gleichzeitig verschiebt sich die Doppelbindung zwischen beiden Stickstoffatomen im Ring. Diese Reaktion ist reversibel und beide Tautomere stehen im Gleichgewicht. In der Strukturformel rechts ist nur ein Tautomer dargestellt.
- isoelektrischer Punkt: 7,59[6]
- van-der-Waals-Volumen: 118
- Hydrophobizitätsgrad: −3,2
Vorkommen
L-Histidin kommt in jungem Pflanzengewebe (gr. ἱστός: Gewebe) vor, daher leitet sich auch der Name ab. L-Histidin erfüllt eine wichtige Aufgabe als Blutpuffer im Hämoglobin (siehe auch Funktionen).
L-Histidin ist in proteinreichen Nahrungsmitteln enthalten. Die folgenden Beispiele geben einen Überblick über Histidingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Histidin am Gesamtprotein angegeben:[7]
Lebensmittel Gesamtprotein Histidin Anteil Rindfleisch, roh 21,26 g 678 mg 3,2 % Hähnchenbrustfilet, roh 21,23 g 791 mg 3,7 % Lachs, roh 20,42 g 549 mg 2,7 % Hühnerei 12,57 g 309 mg 2,4 % Kuhmilch, 3,7 % Fett 3,28 g 89 mg 2,7 % Walnüsse 15,23 g 391 mg 2,6 % Weizenkeime, getrocknet 23,15 g 643 mg 2,8 % Weizen-Vollkornmehl 13,70 g 317 mg 2,3 % Mais-Vollkornmehl 6,93 g 211 mg 3,0 % Reis, ungeschält 7,94 g 202 mg 2,5 % Sojabohnen, getrocknet 36,49 g 1097 mg 3,0 % Erbsen, getrocknet 24,55 g 597 mg 2,4 % Es ist auch Bestandteil mancher Medikamente und Vitaminpräparate.
Synthese
Im Stoffwechsel wird L-Histidin aus Phosphoribosylpyrophosphat (PRPP) und ATP in einer Abfolge von elf Reaktionen, die von acht Enzymen katalysiert werden, über mehrere Zwischenprodukte, u. a. Imidazolglycerinphosphat, synthetisiert.
L-Histidin ist ein Vorläufer in der Biosynthese von Histamin und Carnosin.
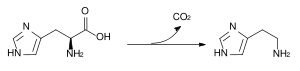 Umwandlung von L-Histidin zu Histamin durch die Histidindecarboxylase
Umwandlung von L-Histidin zu Histamin durch die Histidindecarboxylase
Abbau
Für den Abbau inklusive Strukturformeln siehe Abschnitt Weblinks
L-Histidin kann entweder zum biogenen Amin Histamin decarboxyliert oder vollständig zu L-Glutamat abgebaut werden. Dabei ist das Enzym Urocanase beteiligt.
Funktionen
Der isoelektrische Punkt von Histidin befindet sich im Neutralbereich. Daher ist es die einzige proteinogene Aminosäure, die unter physiologischen Bedingungen sowohl Protonendonator als auch Protonenakzeptor sein kann. Als Beispiel dafür findet sich seine Rolle in der „katalytischen Triade“ (Asp-His-Ser) von Serinproteasen. Von funktioneller Bedeutung sind auch das „distale“ und das „proximale“ Histidin (Teile des Eisen-Bindungsplatzes) im Blutfarbstoff Hämoglobin und dem Muskelfarbstoff Myoglobin. Ebenfalls wichtige Bedeutung hat es als Ligand von Metallionenkomplexen der Elektronentransportketten in den Mitochondrien (oxidative Phosphorylierung) und in den Chloroplasten (Photosynthese).
In wässriger Lösung protolysiert Histidin entsprechend dem pH-Wert sowie seiner pKs-Werte wie in der Abbildung gezeigt.
Verwendung
Bestandteil von Infusionslösungen zur parenteralen Ernährung, peroral bei Gelenkrheumatismus und gegen renale Anämie.[8]
Einzelnachweise
- ↑ a b Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart 1992.
- ↑ a b c F.A. Carey: Organic Chemistry, 5th edition, The McGraw Companies 2001, S. 1059, Link
- ↑ a b c Datenblatt Histidin bei Merck, abgerufen am 13. März 2010.
- ↑ Jan Koolman, Klaus-Heinrich Röhm: Taschenatlas der Biochemie. 3. Auflage, Georg Thieme Verlag, 2003, ISBN 3-13-759403-0, S. 60.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 62, 1982, ISBN 3-527-25892-2.
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Ausgabe
- ↑ S. Ebel und H. J. Roth (Herausgeber): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 66, ISBN 3-13-672201-9.
Weblinks
 Wikibooks: Abbau von Histidin – Lern- und Lehrmaterialien
Wikibooks: Abbau von Histidin – Lern- und Lehrmaterialien Proteinogene Aminosäuren
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Hydroxylysin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Histidīn — C6H9N3O2 entsteht aus Hämoglobin bei Behandlung mit rauchender Salzsäure und tritt als Zersetzungsprodukt von Eiweißkörpern auch im Darm auf, es ist als Aminomethyldihydropyrimidinkarbonsäure aufzufassen und steht in naher Beziehung zu den… … Meyers Großes Konversations-Lexikon
Histidin — Histidin, Abk. His, Proteinbaustein, heterozyklische, nur schwach basische Aminosäure, die in den aktiven Zentren von Enzymen und im Häm sowohl als Protonendonator als auch als Protonenakzeptor fungieren kann. Aus H. entsteht durch… … Deutsch wörterbuch der biologie
histidin — histìdīn m <G histidína> DEFINICIJA kem. C6H9O2N3, jedna od esencijalnih aminokiselina, važan sastojak mnogih biljnih i životinjskih bjelančevina … Hrvatski jezični portal
Histidin — His|ti|din 〈n.; s; unz.; Biochem.〉 eine Aminosäure [zu grch. histion „Gewebe“] * * * His|ti|din [↑ hist u. ↑ idin (3)], das; s; Symbol (für L Histidin): H, His; Syn.: 2 Amino 3 (4 imidazolyl)propionsäure: farblose, optisch aktive krist. Verb.,… … Universal-Lexikon
Histidin — His|ti|din 〈n.; Gen.: s; Pl.: unz.; Biochemie〉 eine Aminosäure [Etym.: <grch. histion »Gewebe«] … Lexikalische Deutsches Wörterbuch
Histidin — Histidi̱n [zu gr. ἱστιον = Gewebe] s; s, e: in fast allen Eiweißkörpern (speziell im Hämoglobin) vorkommende basische Aminosäure … Das Wörterbuch medizinischer Fachausdrücke
Histidin — His|ti|din das; s <zu gr. histíon »Gewebe« u. ↑...in> eine essenzielle ↑Aminosäure, Baustein vieler ↑Proteine … Das große Fremdwörterbuch
histidin — his·ti·din … English syllables
histidin — noun see histidine … Useful english dictionary
L-Histidin — Strukturformel L Histidin (links) bzw. D Histidin (rechts) … Deutsch Wikipedia