- Tuftsin-Defizienz
-
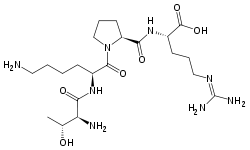
Tuftsin Strukturformel Größe 4 Aminosäuren Precursor Leukocinin Bezeichner Externe IDs UniProt: P01858 Tuftsin ist eine Peptid, das aus den Aminosäuren Threonin, Lysin, Prolin, Arginin (Thr-Lys-Pro-Arg) besteht. Es ist ein Gewebshormon der Phagozytose.[1]
Inhaltsverzeichnis
Funktion
Tuftsin ist als Botenstoff verantwortlich für die Chemotaxis, die Phagozytose und den oxidativen Burst der neutrophilen Granulozyten und Makrophagen.[2] Es ist ein endogenes Adjuvans. Des Weiteren hat Tuftsin einen Einfluss auf die Bildung von Antikörpern.
Granulozyten und Makrophagen, beziehungsweise Monozyten, haben an ihrer Oberfläche Rezeptoren für Tuftsin.[2] Entsprechend modifiziertes Tuftsin kann daher als Target für die Bildgebung von Entzündungen verwendet werden.[2]
Der Einsatz von Tuftsin in der Immuntherapie wird von verschiedenen Autoren diskutiert.
Ein Antagonist von Tuftsin ist das Pentapeptid Thr-Lys-Pro-Pro-Arg, das an die gleichen Rezeptoren der neutrophilen Granulozyten oder Makrophagen, beziehungsweise Monozyten, wie Tuftsin bindet, aber nicht die stimulierende Wirkung entfaltet.[3]
Produktion im menschlichen Körper
Die Thr-Lys-Pro-Arg-Sequenz ist Bestandteil von Immunglobulin G (IgG). Tuftsin entsteht in der Milz durch proteolytische Spaltung der schweren Kette von IgG in der Position 289 und 292.[1] Das in der Milz vorhandene Enzym Tuftsin-Endocarboxypeptidase spaltet IgG so, dass zunächst die Carboxy-Seite des Tuftsins freigelegt wird. Danach bindet das Fragment über den Tuftsin-Rezeptor an das Carrier-Molekül Leukokinin von neutrophilen Granulozyten oder Monozyten, beziehungsweise Makrophagen. Schließlich wird das Fragment durch das Membranenzym Leukokininase in das Tetrapeptid Tuftsin gespalten, das dann seine volle biologische Aktivität entfalten kann.[4]
Nach einer operativen Entfernung der Milz (Splenektomie) kommt es zu einer Tuftsin-Defizienz. Dies ist eine Verringerung der chemotaktischen und phagozytären Aktivität der neutrophilen Granulozyten.[1] Die Tuftsin-Defizienz äußert sich in einer erhöhten Anfälligkeit gegenüber bestimmten Infektionskrankheiten.
Entdeckung
V. Najjar und K. Nishioka entdeckten 1970 gemeinsam das Tuftsin.[5]. Sie benannten das Oligopeptid nach der Tufts University in Medford (Massachusetts), einem Vorort von Boston, wo sie das Tuftsin entdeckten.
Einzelnachweise
- ↑ a b c M. Ferencik u. a.: Wörterbuch Allergologie und Immunologie.,Springer, 2005, S.327. ISBN 3-211-20151-3
- ↑ a b c M. Chianelli u. a.: Radiopharmaceuticals for the study of inflammatory processes: A review. In: Nucl. Med. Commun., 18, 1997, S.437–455.
- ↑ K. Frank: Application of the New Radiopharmaceutical Tekappran to Aid in Diagnosing Inflammation of Soft Tissue in Horses Using Scintigraphic Imaging, Dissertation, Tierärztliche Hochschule Hannover, 2001.
- ↑ V. A. Najjar: Tuftsin, A Natural Activator of Phagocyte Cells: An Overview. In: Ann NY Acad Sci, 419, 1983, S. 1–11.
- ↑ V. Najjar, K. Nishioka: "Tuftsin": a natural phagocytosis stimulating peptide. In: Nature, 228, 1970, S. 672–673. PMID 4097539
Literatur
- M. Fridkin, P. Gottlieb:Tuftsin: Thr-Lys-Pro-Arg. Anatomy of an immunologically active peptide. In: Mol Cell Biochem, 41, 1981, S. 73–97
- K. Nishioka u. a.: Characteristics and isolation of the phagocytosis-stimulating peptide, tuftsin. In: Biochim Biophys Acta, 310, 1973, S. 217–229. PMID 4122886
- K. Nishioka u. a.: A comparative study of [Leu1]Tuftsin and tuftsin, a natural phagocytosis-stimulating peptide. In: Int J Biochem, 23, 1991, S. 627–630. PMID 2065822
- K. Nishioka u. a.: Studies of human granulocyte phagocytosis stimulation by tuftsin. In: J Surg Res, 56, 1994, S. 94–101. PMID 8277776
- K. Nishioka u. a.: Enhanced phagocytosis activity of cyclic analogs of tuftsin. In: Biochem Pharmacol, 49, 1995, S. 735–738. PMID 7887989
- S. Kubo u. a.: Stimulation of phagocytic activity of murine Kupffer cells by tuftsin. In: Hepatology, 19, 1994, S. 1044–1049. PMID 8138244
- J. O. Naim, C. J. van Oss: The generation of antibody in mice to tuftsin: a naturally occurring phagocytosis stimulating tetrapeptide. In: Immunol Invest, 20, 1991, S. 351–364. PMID 1937582
Wikimedia Foundation.