- Bell-Evans-Polanyi-Prinzip
-
Das Bell-Evans-Polanyi-Prinzip ist ein Modell, das eine energetische Beziehung zwischen der Aktivierungsenthalpie und der Reaktionsenthalpie einer chemischen Reaktion aufstellt. Es besagt, dass innerhalb einer Reihe ähnlicher Reaktionen, eine lineare Beziehung zwischen den obigen Reaktionskonstanten gegeben ist.[1] Die Aktivierungsenthalpie ist also umso geringer je geringer die Reaktionsenthalpie ist. Die Grundlagen wurden in den 1930er Jahren in Publikationen von R. P. Bell[2] sowie M. G. Evans und M. Polanyi[3] beschrieben.
Das Bell-Evans-Polanyi-Prinzip erlaubt sowohl thermodynamische als auch kinetische Aussagen über eine Serie chemischer Reaktionen zu formulieren:
- Exothermere Reaktionen besitzen einen energetisch günstigeren (früheren, eduktähnlicheren) Übergangszustand.
- Ein energetisch günstigeres Produkt bewirkt eine niedrigere Reaktionsbarriere und somit eine schneller ablaufende Reaktion (vergleiche auch Arrhenius-Gleichung).
Die allgemeine Ableitung aus dem Bell-Evans-Polanyi-Prinzip ist das Hammond-Postulat.
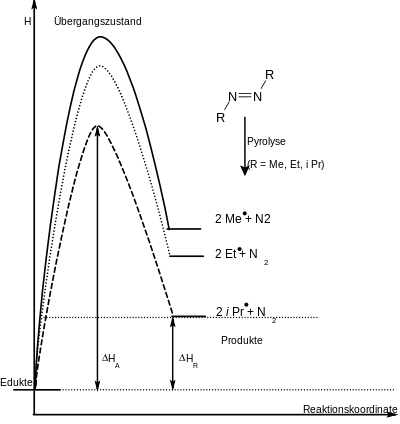
Ein gutes Beispiel für das Bell-Evans-Polanyi-Prinzips ist die Pyrolyse von Azoverbindungen. Hierbei wird aus der eingesetzten Azoverbindung molekularer Stickstoff freigesetzt, wobei die Radikale der entsprechenden organischen Reste gebildet werden. Die Reaktionsenthalpie ΔHR ist hierbei abhängig vom Energieinhalt der Edukte und der Stabilisierung der entstehenden Radikale. Die Aktivierungsenthalpien ΔHA verhalten sich relativ jedoch wie die Reaktionsenthalpien (siehe Abbildung).
Quellen
- ↑ IUPAC Goldbook
- ↑ R. P. Bell: The Theory of Reactions Involving Proton Transfers, in: Proc. Roy. Soc. London 1936, 154A; doi:10.1098/rspa.1936.0060.
- ↑ M. G. Evans, M. Polanyi: Inertia and driving force of chemical reactions, in: Trans. Faraday Soc. 1938, 34, 11–24; doi:10.1039/TF9383400011.
Literatur
- Josep Maria Anglada, Emili Besalú, Josep Maria Bofill, Ramon Crehuet: Prediction of approximate transition states by Bell-Evans-Polanyi principle: I. Journal of Computational Chemistry, 20(11), 1112–1129; doi:10.1002/(SICI)1096-987X(199908)20:11<1112::AID-JCC2>3.0.CO;2-2.
- Josep Maria Anglada, Emili Besalú, Josep Maria Bofill, Ramon Crehuet: Prediction of approximate transition states by Bell-Evans-Polanyi principle: II. Gas phase unimolecular decomposition of methyldioxirane. Journal of Computational Chemistry, 20(11), 1130–1137; doi:10.1002/(SICI)1096-987X(199908)20:11<1130::AID-JCC3>3.0.CO;2-3.
Wikimedia Foundation.