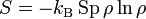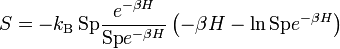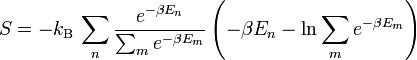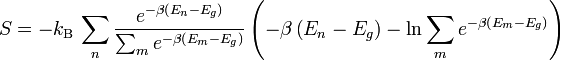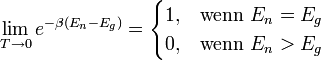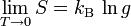- Wärmetheorem
-
Das Nernstsche Theorem, oft auch Nernstscher Wärmesatz genannt (nach dem deutschen Physiker Walther Nernst), ist eine andere Bezeichnung für den dritten Hauptsatz der Thermodynamik. Er sagt aus, dass der absolute Nullpunkt der Temperatur nicht erreicht werden kann.
Der Satz kann unter Zuhilfenahme der Quantentheorie bewiesen werden (s.u.).
In Experimenten wurde er erwartungsgemäß nicht widerlegt, da es nur gelungen ist, sich dem absoluten Nullpunkt immer weiter anzunähern, aber nie, ihn zu erreichen.
Formulierung
Das Theorem wurde 1905 von Nernst aufgestellt und behandelt die Änderung der Entropie S einer chemischen Reaktion bei einer Temperatur von null Kelvin: sie geht gegen null.
Die Formulierung wurde 1911 von Max Planck schärfer gefasst. Danach wird die Entropie unabhängig von thermodynamischen Parametern und somit konstant, wenn die Temperatur gegen null geht:
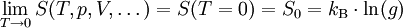 ,
,
wobei kB die Boltzmann-Konstante ist und g die Entartung des Grundzustandes.
Ist der Grundzustand des Systems nicht entartet, so gilt g = 1 und damit S0 = 0. Somit verschwindet die Entropie eines Systems, wenn die Temperatur gegen null geht.
Beweis für kanonische Verteilung
Zuerst wird der statistische Operator ρ durch seine Darstellung in der kanonischen Verteilung ersetzt.
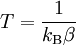 ist hierbei die empirische Temperatur.
ist hierbei die empirische Temperatur.Wertet man die Spur über die Operatoren aus, erhält man:
Nun wird die Energie des Grundzustandes von jedem Niveau abgezogen.
Es gilt nun für
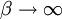 (entspricht
(entspricht 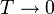 ):
):Setzt man diese Erkenntnis in die obige Doppelsummendarstellung ein, erhält man die gesuchte Formulierung des Nernst-Theorems nach Planck:
Siehe auch
Erster Hauptsatz der Thermodynamik
Zweiter Hauptsatz der Thermodynamik
Wikimedia Foundation.