- Zustandsgröße
-
Eine Zustandsgröße ist eine makroskopische physikalische Größe oder ein Parameter in einer Zustandsgleichung, die nur vom momentanen Zustand des betrachteten physikalischen Systems abhängt und daher vom Weg, auf dem dieser Zustand erreicht wurde, unabhängig ist. Sie beschreibt also eine Eigenschaft des Systems in diesem Zustand. Beispiele sind die Energie, Entropie, Volumen, Masse, Temperatur, Druck, Dichte, Polarisation und Magnetisierung des betrachteten Systems.
Den Wechsel zwischen zwei verschiedenen Zuständen und damit auch die Veränderung der Zustandsgrößen bezeichnet man als Zustandsänderung. Zwei Zustände werden dann als verschieden angesehen, wenn die numerischen Werte wenigstens einer der Zustandsgrößen verschieden sind.
Inhaltsverzeichnis
Beispiel
Für die momentane potentielle Energie einer Person auf einem Berggipfel (Zustandsgröße) ist es gleichgültig, auf welchem Weg die Person den Gipfel erreicht hat. Die aufgewendete Arbeit hingegen, die die Person aufbringen muss, um diese potentielle Energie zu erreichen, hängt natürlich vom zurückgelegten Weg ab. Dieser kann z.B. geradlinig oder entlang einer Zylinderspirale erfolgen und die Reibungsarbeit ist so auf beiden Wegen unterschiedlich (auch die Fortbewegung in der Horizontalen erfordert erfahrungsgemäß Kraft- und Arbeitsaufwand, vgl. Prozessgröße, Dissipation).
Zustandsgrößen in der Thermodynamik
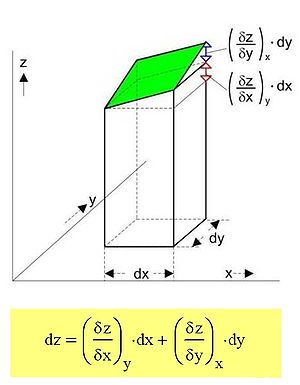 Bildliche Darstellung einer intensiven Zustandsgröße z, die (bei einem homogenen Einphasensystem, z. B. ideales Gas) durch 2 andere, voneinander unabhängige Zustandsgrößen (hier x und y) eindeutig beschrieben werden kann. Die Größe z ist immer dann eine Zustandsgröße, wenn sie ein vollständiges Differential besitzt, mit anderen Worten, sie lässt sich als Punkt auf einer stetig verlaufenden Fläche im Raum darstellen.
Bildliche Darstellung einer intensiven Zustandsgröße z, die (bei einem homogenen Einphasensystem, z. B. ideales Gas) durch 2 andere, voneinander unabhängige Zustandsgrößen (hier x und y) eindeutig beschrieben werden kann. Die Größe z ist immer dann eine Zustandsgröße, wenn sie ein vollständiges Differential besitzt, mit anderen Worten, sie lässt sich als Punkt auf einer stetig verlaufenden Fläche im Raum darstellen.
In der Thermodynamik erfolgt die eindeutige Beschreibung eines Systems unter anderem mittels der Zustandsgrößen Druck p, (absolute) Temperatur T, Volumen V und Teilchenzahl N bzw. Stoffmenge n, Dichte ρ, innere Energie U, Enthalpie H und Entropie S. Diese Zustandsgrößen bleiben konstant, wenn sich ein System im thermodynamischen Gleichgewicht befindet.
Bei den Zustandsgrößen werden intensive und extensive Größen unterschieden. Intensive Zustandsgrößen sind von der Größe des Systems (von der Stoffmenge) unabhängig, also beispielsweise Druck und Temperatur. Extensive Zustandsgrößen sind von der Größe des Systems (von der Stoffmenge) abhängig, so wie beispielsweise Teilchenzahl und Volumen.
Im Bierglas-Beispiel: Die Biermenge im Glas ist eine extensive Größe, da zwei Gläser die doppelte Menge Bier enthalten. Die Temperatur des Bieres hingegen ist eine intensive Größe, da zwei Gläser Bier nicht doppelt so warm sind wie ein einzelnes.Experimentelle Befunde zeigen, dass die genannten Größen nicht voneinander unabhängig geändert werden können, was auch in der Gibbssche Phasenregel beziehungsweise in der Festlegung des Zustands eines Systems auf eine bestimmte Anzahl Freiheitsgrade zum Ausdruck kommt. Den Zusammenhang zwischen den Zustandsgrößen eines Systems beschreiben Zustandsgleichungen. Die meisten realen Systeme können nicht durch Zustandsgleichungen beschrieben werden, da zwischen deren Zustandsgrößen keine mathematische Beziehung formuliert werden kann.
Bei Gasen sehr geringer Dichte hingegen lässt sich ein solcher Zusammenhang unter bestimmten Bedingungen, wie einem geringen Druck und einer hohen Temperatur, näherungsweise durch die Annahme eines idealen Verhaltens beschreiben, was in der allgemeinen Gasgleichung ausformuliert wurde:mit R = 8,3145 J/(mol·K) – allgemeine Gaskonstante
Ebenfalls nur mit einer Näherung, jedoch gültig auch für stärker reale Gase, ist die Van-der-Waals-Gleichung:
Zustandsfunktionen wie die innere Energie oder die Enthalpie eines Systems sind aus den grundlegenderen Zustandsgrößen abgeleitete Größen, welche man in der Zustandsgleichung in der Folge als Zustandsvariablen bezeichnet und welche daher ihrerseits wiederum Zustandsgrößen darstellen, also auch wegunabhängig sind. Hierbei entscheidet der Einzelfall, welche Größe man als Zustandsfunktion und welche man als Zustandsvariablen nutzt, so dass beispielsweise auch die Enthalpie, wie bei der Definition der freien Enthalpie, wiederum als eine Zustandsvariable genutzt werden kann. Einige Beziehungen zwischen den verschiedenen Zustandsgrößen hat man unter dem Begriff der Maxwell-Beziehungen zusammengefasst.
Eine weitere Einteilungsmethode teilt die Zustandsgrößen in äußere und innere Zustandsgrößen.
Zustandsgrößen in der Astrophysik
In der Astrophysik charakterisieren Zustandsgrößen unter anderem Sterne, indem beispielsweise ihre Oberflächentemperatur, Schwerebeschleunigung an der Oberfläche, Leuchtkraft, Masse und Radius betrachtet werden.
Kritik
Der Name Zustandsgröße wurde eingeführt, um zum Ausdruck zu bringen, dass eine Größe in einem Zustand einen bestimmten Wert hat. Nun ist das allerdings für alle physikalischen Größen der Fall, mit nur zwei Ausnahmen: der Arbeit und der Wärme. Wenn man aber bei nur einigen wenigen Größen betont, sie seien Zustandsgrößen, so entsteht der Eindruck, Zustandsgrößen seien nicht der Normalfall, sondern die Ausnahme.[1]
Literatur
Siehe auch
Einzelnachweise
Weblinks
- Bundeswehr-Uni, München (PDF-Datei; 9,26 MB)
- Maschinenbau-FH (Thermodynamik)
Wikimedia Foundation.


