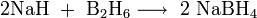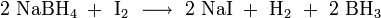- Borhydride
-
Borane sind Borwasserstoffverbindungen (Borhydride) und deren Derivate, über die als erstes Alfred Stock 1912 veröffentlichte. Das sich danach entwickelnde Gebiet der Chemie der Borane und der verwandten Carbaborane sowie Metallaborane ist eines der vielfältigsten Entwicklungsfelder in der anorganischen Chemie. Es wurden zahlreiche neutrale Borane BnHm, Borananionen BnHmy- und Borankationen BnHmx+ synthetisiert. Borane sind Elektronenmangelverbindungen, da mehr Atome kovalent miteinander verknüpft sind als Elektronenpaare vorhanden sind. Dies führt zu ungewöhnlich hohen Bindigkeiten und Koordinationszahlen. Maßgeblich sind hierfür sogenannte Mehrzentrenbindungen (hauptsächlich Dreizentrenbindungen). Man unterscheidet die Borane hinsichtlich Stöchiometrie und Struktur in hypercloso-, closo-, nido-, arachno-, hypho-, commo- und conjuncto-Borane. Die Geometrie dieser Boranstrukturen ist durch das Verhältnis der Anzahl der Gerüstelektronen zu der Anzahl der Gerüstatome bestimmt. Die Strukturen lassen sich mit der Wade-Regel, bei komplizierteren, ineinander verquickten Boran-Clustern (z. B. commo-Borane) mit der mno-Regel nach Balakrishnarajan und bei sehr großen Boranen mit der (6m+2n)-Regel nach Paul von Rague-Schleyer bestimmen. Besonders die closo-Borane wie B6H62-, B9H92-, B10H102-, B12H122-, B21H18- und B20H16 sind im Vergleich mit simpleren Boranen wie B2H6 oder B10H14 sehr stabil. Diese Stabilität beruht hauptsächlich auf sterischen Effekten (hohe Symmetrien, geschlossene Käfige ohne verbrückende Wasserstoffe, …).
William Lipscomb erhielt für seine Arbeiten über Borane und Carbaborane 1976 den Nobelpreis für Chemie.
Die Umsetzung von Diboran B2H6 mit Sauerstoff zu Borsesquioxid B2O3 ist eine der stärksten exothermen Reaktionen, die bekannt sind. Dies weckte vor allem Interesse beim Militär wegen eines Einsatzes als Raketentreibstoff, so dass in diesem Bereich intensive Grundlagenforschung betrieben wurde. Nach 15 Jahren wurde die militärische Forschung wegen unterschiedlicher Probleme eingestellt: die an der Reaktion beteiligten Stoffe sind instabil, geruchsintensiv, giftig und vor allem klebrig, was eine Verwendung in Triebwerken ausschließt.
Die Salze von Boranen werden als Boranate, Hydroborate oder Hydridoboranate, die entsprechenden Anionen als Boranat-Ionen (Monoboranat/Tetrahydroboranat/Tetrahydridoboranat BH4-, Diboranat B2H7- und Dekaboranat B10H10-) bezeichnet. Sie werden als Reduktions- und Hydrierungsmittel eingesetzt. Wichtige Vertreter sind Natriumboranat und Lithiumboranat. Natriumboranat entsteht durch Reaktion von Natriumhydrid mit Diboran.[1]
Inhaltsverzeichnis
Herstellung im Labor
Boran kann als Tetrahydrofuran-Komplex (BH3·THF) leicht aus Natriumboranat und elementarem Iod in situ hergestellt werden.
Boran-Tetrahydrofuran-Komplex ist aber auch kommerziell erhältlich.
Verwendung in der organischen Synthese
Boran hat in der organischen Synthese zwei Hauptanwendungen. Die von Herbert Charles Brown entdeckte und erforschte Hydroborierung für dessen systematische Untersuchung er auch 1979 den Nobelpreis für Chemie erhielt. Bei dieser Reaktion wird formal Wasser in einer Anti-Markownikow-Addition an eine Kohlenstoff-Kohlenstoff-Doppelbindung addiert. Eine weitere wichtige Verwendung findet Boran bei der Reduktion von Carbonsäuren bzw. deren Derivaten zu primären Alkoholen.
Referenzen
H. C. Brown, Nobelpreisvortrag
Einzelnachweise
Wikimedia Foundation.