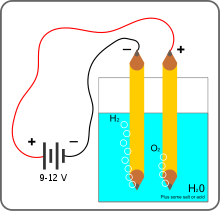
- Wasserelektrolyse
-
Unter Wasserelektrolyse versteht man die Zerlegung von Wasser in Wasserstoff und Sauerstoff mit Hilfe eines elektrischen Stromes. Die wichtigste Anwendung dieser Elektrolyse ist die Gewinnung von Wasserstoff, die allerdings bisher technisch nur genutzt wird, wenn günstige elektrische Energie zur Verfügung steht, da andernfalls andere Herstellungsmethoden günstiger sind, z. B. ausgehend von Erdöl oder Kohle. Wenn diese Rohstoffe und Energieträger knapp werden, könnte die Wasserelektrolyse im Rahmen der Wasserstoffwirtschaft, die Wasserstoff als Energieträger nutzt, bedeutsam werden.
Durch den starken Ausbau der erneuerbaren Energien erlangt die Wasserelektrolyse zunehmend Bedeutung als Herstellungsverfahren von sog. EE-Gas. Mit Wasserstoff als Energiespeicher wird die Verstetigung der Stromerzeugung aus erneuerbaren Energien, insbesondere bei Windkraft und Fotovoltaik, gefördert. Durch Nutzung von Erzeugungsspitzen aus diesen erneuerbaren Energien wird durch Elektrolyse die überschüssige Energie genutzt und entweder direkt in Form von Wasserstoff oder nach anschließender Methanisierung als Methan dem Erdgasnetz zugeführt.
Die Wasserelektrolyse ist auch als Demonstrationsversuch bedeutsam; dabei wird oft der Hofmannsche Wasserzersetzungsapparat genutzt. Eine weitere Anwendung der Wasserelektrolyse ist die Anreicherung von Deuterium. Ferner ist die Wasserelektrolyse die wichtigste Nebenreaktion vieler technischer Elektrolysen, z. B. der Chloralkali-Elektrolyse.
Inhaltsverzeichnis
Reaktionen und ihre Gleichungen
Die Elektrolyse von Wasser besteht aus zwei Teilreaktionen, die an den beiden Elektroden (Kathoden- und Anodenräumen) ablaufen. Das Gesamt-Reaktionsschema dieser Redoxreaktion lautet:

- Wasser wird durch elektrischen Strom in Wasserstoff und Sauerstoff gespalten.
Die Elektroden tauchen in Wasser ein, welches durch die Zugabe von etwas Säure, bevorzugt Schwefelsäure, oder Lauge besser leitend gemacht wird. Auch die Verwendung von Kochsalz als Elektrolyt ist möglich, wobei allerdings je nach Elektroden und Stromdichte neben oder anstatt Sauerstoff auch Chlor entsteht. Großtechnisch wird bei der Wasserelektrolyse eine hochkonzentrierte wässrige KOH-Lösung verwendet.
Positiv geladene Oxonium-Ionen (H3O+) wandern im elektrischen Feld zu der negativ geladenen Elektrode (Kathode), wo sie jeweils ein Elektron aufnehmen. Dabei entstehen Wasserstoff-Atome, die sich mit einem weiteren, durch Reduktion entstandenen H-Atom zu einem Wasserstoffmolekül vereinigen. Übrig bleiben Wassermoleküle.
Kathodenraum: 2 H3O+ + 2 e− → H2 + 2 H2O oder auch: 2 H2O + 2 e− → H2 + 2 OH−
Der abgeschiedene, gasförmige Wasserstoff steigt an der Kathode auf, wobei der Kathodenraum basischer wird. Die negativ geladenen Hydroxid-Anionen wandern zur positiven Anode – soweit dies nicht durch die Teilung von Anoden- und Kathodenraum oder den Einsatz von Leitsalzen oder Ionenaustauschern verhindert wird – wobei sich negative Hydroxidionen mit Protonen zu Wasser neutralisieren oder sich an der Anode unter Elektronenabgabe zu Sauerstoff umwandeln.
Anodenraum: 4 OH− → O2 + 2 H2O + 4 e− oder auch: 6 H2O → O2 + 4 H3O+ + 4 e−
Auch hier steigt der abgeschiedene Sauerstoff als Gas an der Anode auf, gleichzeitig wird der Anodenraum saurer. Die entstandenen Protonen wandern in Richtung Kathode – analog zu den Vorgängen im Kathodenraum.
Die Gesamtreaktionsgleichung der Elektrolyse von Wasser lautet:
4 H3O+ + 4 OH− → 2 H2 + O2 + 6 H2O
Die auf der linken Seite stehenden Hydronium- (neuer: „Oxonium-Ionen“) und Hydroxid-Ionen entstammen der Autoprotolyse des Wassers:
8 H2O → 4 H3O+ + 4 OH−
Man kann die Elektrolysegleichung daher auch folgendermaßen schreiben:
8 H2O → 2 H2 + O2 + 6 H2O
bzw. nach Kürzen des Wassers:
2 H2O → 2 H2 + O2
Technische Wasserelektrolysen
Der energetische Wirkungsgrad der Elektrolyse von Wasser liegt über 70 %. Mehrere Anlagenhersteller (z. B. Electrolyser Corp., Brown Boveri, Lurgi, De Nora, Epoch Energy Technology Corp.) bieten große Elektrolysegeräte mit einem noch höheren Wirkungsgrad – über 80 % – an. Da die Elektrolytkonzentration und die Temperatur einer Elektrolytlösung großen Einfluss auf den Zellwiderstand und somit auf die Energiekosten haben, wird bei modernen Anlagen eine 25–30 %ige Kaliumhydroxid-Lösung verwendet, die Temperatur liegt bei ca. 70–90 °C. Die Stromdichte liegt bei ca. 0,15–0,5 A/cm2, die Spannung bei ca. 1,90 V. Zur Herstellung von 1 m3 Wasserstoff wird bei modernen Anlagen eine Stromenergie von 4,3–4,9 kWh benötigt. Ein großer Druckelektrolyseur von Lurgi hat eine Leistung von 760 m3/h Wasserstoff bei ca. 3,5 MW (Stackleistung)[1] und ca. 4,5 MW Eingangsleistung AC. Durch Elektrokatalysatoren (bei Kathoden z. B.: Ni-Co-Zn, Ni-Mo, bei Anoden: Nickel-Lanthan-Perowskit, Nickel-Kobalt-Spinell) kann die Überspannung um ca. 80 mV gesenkt werden.
Es besteht auch die Möglichkeit destilliertes Wasser durch Elektrolyse zu zerlegen. Bei der SPE-Wasserstoffelektrolyse wird eine protonengeladene Nafionmembran benutzt. Die dünnen durchbrochenen Elektroden befinden sich auf der Oberflächenschicht (zero-gap = abstandsfreie Zellengeometrie) der Membran. Als Elektrodenmaterial können z. B. Rutheniumoxidhydrate (Anode) oder Platin (Kathode) verwendet werden. Die SPE-Elektrolyse scheint sich als Markt für Kleinelektrolyseure durchzusetzen. [2]
Aktuell wird auch an der Hochtemperatur-Wasserdampf-Elektrolyse (bei 800–1000 °C) an Festelektrolyten geforscht. Als Festelektrolyt kann ein Calcium-Yttrium-Zirkonoxid oder auch ein Perowskit (z. B. LaCrO3) verwendet werden. Mit derartigen Systemen ließ sich die benötigte Spannung auf 1,30 V senken, die Stromdichte lag bei 0,4 A/cm2.[3] Der Wirkungsgrad ist insbesondere bei der Nutzung von Wasserstoff als Energiespeicher wichtig, wenn beispielsweise aus saisonal, regional oder tageszeitbedingt schwankenden regenerativen Energiequellen eine stabile Stromversorgung mittels Brennstoffzellen etabliert werden soll. Eine weitere technische Anwendung mit ähnlichem Hintergrund ist die Erzeugung von Windgas (Solargas).
Nebenreaktionen[4]
a) Bildung von Ozon
An glatten Platinanoden kommt es in gekühlten (die Ozonzersetzung ist dann geringer), stark sauren Lösungen, bei hohen Stromdichten zu einer erheblichen Ozonbildung. Im basischen Milieu ist die Ozonbildung geringer, an Nickelanoden bleibt sie sogar völlig aus.
Überlagert man dem Gleichstrom einen Wechselstrom, so erfolgt die Ozonbildung bei deutlich geringeren Stromdichten. Bei der Elektrolyse von Schwefelsäure mit einer Dichte von 1,478 g/cm3, einem Gleichstrom von 0,75 A/cm2 und einem Wechselstrom von 4,5 A/cm2 bilden sich 37 % Ozon.
b) Bildung von Wasserstoffperoxid
Wasserstoffperoxid kann sich vorwiegend an der Kathode bilden.
Bei sehr geringen Stromdichten (unter 0,001 A/cm2) in 1%iger Schwefelsäure ist die Wasserstoffperoxidbildung an Quecksilberkathoden sogar fast quantitativ. Nach diesem Verfahren lassen sich 0,3%ige Wasserstoffperoxidlösungen herstellen, wenn Kathoden– und Anodenraum durch ein Diaphragma getrennt sind.
Siehe auch
- Elektrolyseur
- Wasserstoffproduktionsschiff Hydrogen Challenger
- Liste der Wasserstofftechnologien
Einzelnachweise
- ↑ http://www.iht.ch/technologie/electrolysis/industry/technical-data.html bzw. http://www.elektrolyse.de/vkp/modules.php?name=Content&pa=showpage&pid=3
- ↑ C.J. Winter u. J. Nitsch: Wasserstoff als Energieträger: Technik und Systeme, Springer Verlag 1986
- ↑ Gerd Sandstede: Möglichkeiten zur Wasserstoff-Erzeugung mit verminderter Kohlendioxid-Emission für zukünftige Energiesysteme, Chem.-Ing.-Tech. 63(1993), Nr. 6, S. 586–589, VCH-Verlagsgesellschaft Weinheim
- ↑ Fritz Foerster: Elektrochemie wässriger Lösungen, Verlag von Johann Ambosius Barth, 1915, S. 206 ff.
Wikimedia Foundation.