- Knallgas
-
Knallgas, im englischem Sprachraum auch Oxyhydrogen genannt, ist eine detonationsfähige Mischung von gasförmigem Wasserstoff (H2) und Sauerstoff (O2). Beim Kontakt mit offenem Feuer (Glut oder Funken) erfolgt die sogenannte Knallgasreaktion. In Luft unter atmosphärischem Druck muss der Volumenanteil des Wasserstoffs dabei zwischen 4 und 77 % liegen. Werden diese Grenzwerte unter- bzw. überschritten, kommt es nicht mehr zu einer Explosion/Detonation. Bei einer kontrollierten Verbrennung kommt es zu einer Knallgasflamme.
Inhaltsverzeichnis
Herstellung
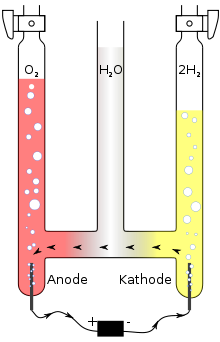
Knallgas lässt sich durch die Wasserelektrolyse, also der elektrolytische Zersetzung von Wasser (H2O) oder durch die thermische Zersetzung von Wasser herstellen. Die thermische Zersetzung von Wasser erfordert Temperaturen oberhalb von 2500 °C.[1]
Bei der Wasserelektrolyse erfolgt die Aufspaltung mit Hilfe von elektrischem Strom. Die Elektroden tauchen in Wasser ein, das durch die Zugabe von etwas Säure, bevorzugt Schwefelsäure oder Lauge, elektrisch leitfähiger gemacht wurde. Auch die Verwendung von Kochsalz als Elektrolyt ist möglich, wobei je nach verwendeten Elektroden und Stromdichte neben bzw. anstatt Sauerstoff auch Chlor entsteht.
Knallgasreaktion
Die Knallgasreaktion ist die exotherm und detonationsartig ablaufende Reaktion von Wasserstoff mit Sauerstoff und verläuft mit einer Detonationsgeschwindigkeit von 2820m/s. Sie ist eine Form der Verbrennung (Oxidation).
Die Reaktionsgleichung lautet:
Es handelt sich um eine stark verzweigte Kettenreaktion (Kettenverzweigungsexplosion) unter Beteiligung von Wasserstoff-, Sauerstoff- und Hydroxyl-Radikalen als Kettenträger.
und weitere Reaktionen
Das Reaktionsprodukt ist Wasser.
Die pro molarem Formelumsatz freiwerdende Energie beträgt 571,6 kJ/mol (ΔrH0 = −571,6 kJ/mol).[2] Damit ändert sich die Enthalpie H für ein Mol des entstehenden Wassers um −286 kJ/mol.
Als Nebenreaktion entsteht auch Wasserstoffperoxid gemäß:
In den Mitochondrien lebender Zellen kommt es bei der Endoxidation im Komplex IV in der Atmungskette zu einer analogen, aber strikt kontrollierten exergonen Reaktion (biologische Knallgasreaktion), die der Energiegewinnung der Zelle, d. h. der Bildung von ATP-Molekülen dient:
Die freie Enthalpie ΔG°' der Reaktion ergibt sich aus ihrem Redoxpotential (+0,5 V) und beträgt bei physiologischen Bedingungen (pH 7) −193 kJ/mol.
Die gleiche Reaktion findet auch in der Brennstoffzelle statt. Bei deren Konstruktion wird die bei der Knallgasreaktion freiwerdende Energie (Enthalpiedifferenz), hier genauer: freie Enthalpie oder Gibbs-Energie ΔG genutzt, ohne eine Explosion herbeizuführen. Die dabei freiwerdende Enthalpie wird zum Teil als elektrischer Strom und zum Teil als Wärme freigesetzt. Die Reaktion läuft in der Brennstoffzelle jedoch langsam und kontrolliert ab.
Knallgasprobe
Mit dem Begriff Knallgasprobe bezeichnet man in der Chemie einen Nachweis von Wasserstoff. Dieser ist jedoch unspezifisch, da auch z. B. Methan mit Sauerstoff Knallgas bildet, und dient nur im Chemieunterricht als Pseudonachweis. Die eigentliche Verwendung (siehe unten) ist das Überprüfen des Luftgehaltes einer Wasserstoff produzierenden Apparatur.
Für den Nachweis wird üblicherweise das zu überprüfende Gas in einem Reagenzglas mit der Öffnung nach unten (damit Wasserstoff wegen der geringeren Dichte als Luft nicht entweichen kann) an eine Zündquelle (Bunsenbrenner, Feuerzeug) gehalten.
Fall 1: Das aufgefangene Gas ist reiner Wasserstoff. Es kommt zu einer ruhigen Verbrennung oder eventuell schwachen Verpuffung (negative Knallgasprobe).
Fall 2: Das aufgefangene Gas ist ein Gemisch aus Wasserstoff und Sauerstoff (Knallgas). Die Verbrennung erfolgt mit einem pfeifenden Geräusch (positive Knallgasprobe).
Aufgrund der unterschiedlichen Geräusche bei reinem Wasserstoff und dem Gemisch Wasserstoff mit Sauerstoff wird die Knallgasprobe auch zur Überprüfung der Reinheit von Wasserstoffgas verwendet, um eine Explosion in einem geschlossenen Gefäß zu vermeiden.
Ähnlich wie Knallgas explodiert das Chlorknallgas.
Anwendung
Dass die Knallgasreaktion auch durch einen Platindraht als Katalysator in Gang gesetzt werden kann, entdeckte Johann Wolfgang Döbereiner. Einige Jahre später gelang ihm die Entzündung eines Knallgasgemisches unter dem Einfluss von Platinschwamm. Diese Entdeckung führte zur Erfindung des ersten Feuerzeuges (des Döbereinerschen Platinfeuerzeugs).
Literatur
- Jander, G., Spandau, H. (1987): Kurzes Lehrbuch der anorganischen und allgemeinen Chemie, Springer-Verlag Berlin Heidelberg.
Einzelnachweise
- ↑ Grundzüge der Anorganischen Chemie I: Hauptgruppenelemente (SS 2003); www.weidenbruch.chemie.uni-oldenburg.de/wac1S.pdf.
- ↑ http://www.rzuser.uni-heidelberg.de/~ltemgoua/chemie/Knallgas.html.
Wikimedia Foundation.