- Lecithin-Retinol-Acyltransferase
-
Lecithin-Retinol-Acyltransferase —
Masse/Länge Primärstruktur 230 Aminosäuren Sekundär- bis Quartärstruktur Membranprotein (ER) Bezeichner Gen-Name LRAT Externe IDs OMIM: 604863 UniProt: O95237 Enzymklassifikation EC, Kategorie 2.3.1.135 Transferase Reaktionsart Übertragung eines Fettsäurerests Substrat 1,2-Diacyllecithin + Retinol Produkte 2-Acyllecithin + Retinylester Vorkommen Übergeordnetes Taxon Wirbeltiere[1] Die Lecithin-Retinol-Acyltransferase (LRAT) ist das Enzym in Wirbeltieren, das die Veresterung von Retinol katalysiert. Diese Reaktion findet in allen Gewebetypen statt, die Vitamin A speichern, besonders aber in Netzhaut, Leber und Darm. Retinylester (im Mensch hauptsächlich Retinylpalmitat) sind außerdem die bevorzugte Form, in der Vitamin A vom Darm zur Leber transportiert wird. LRAT ist in der Membran des ER lokalisiert und bezieht eines der beiden Substrate von dort. Mutationen im LRAT-Gen sind eine Ursache für Retinitis pigmentosa.[2][3]
Ratten ohne LRAT sind nicht in der Lage, Vesikel in Leber-Ito-Zellen zu bilden, die als Fettspeicher dienen. Die Speicherung von Vitamin A in der Netzhaut wurde an Mäusen untersucht und war abhängig von der Anwesenheit von LRAT. In vielen menschlichen Krebs-Zelllinien ist die Genexpression von LRAT erniedrigt. Auf der anderen Seite reagieren Mäuse mit erhöhter LRAT-Expression empfindlicher auf Karzinogene im oralen Bereich.[4][5][6][7]
Katalysierte Reaktion
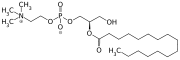
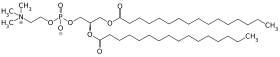
All-trans-Retinol und Dipalmitoyllecithin werden zu Retinylpalmitat und 2-Palmitoyllecithin umgesetzt.
Einzelnachweise
- ↑ Homologe bei OMA
- ↑ UniProt O95237
- ↑ Moise AR, Golczak M, Imanishi Y, Palczewski K: Topology and membrane association of lecithin: retinol acyltransferase. In: J. Biol. Chem.. 282, Nr. 3, Januar 2007, S. 2081–90. doi:10.1074/jbc.M608315200. PMID 17114808.
- ↑ Blaner WS, O'Byrne SM, Wongsiriroj N, et al.: Hepatic stellate cell lipid droplets: a specialized lipid droplet for retinoid storage. In: Biochim. Biophys. Acta. 1791, Nr. 6, Juni 2009, S. 467–73. doi:10.1016/j.bbalip.2008.11.001. PMID 19071229. Volltext bei PMC: 2719539.
- ↑ Ruiz A, Ghyselinck NB, Mata N, et al.: Somatic ablation of the Lrat gene in the mouse retinal pigment epithelium drastically reduces its retinoid storage. In: Invest. Ophthalmol. Vis. Sci.. 48, Nr. 12, Dezember 2007, S. 5377–87. doi:10.1167/iovs.07-0673. PMID 18055784.
- ↑ Cai K, Gudas LJ: Retinoic acid receptors and GATA transcription factors activate the transcription of the human lecithin:retinol acyltransferase gene. In: Int. J. Biochem. Cell Biol.. 41, Nr. 3, März 2009, S. 546–53. doi:10.1016/j.biocel.2008.06.007. PMID 18652909. Volltext bei PMC: 2628449.
- ↑ Tang XH, Su D, Albert M, Scognamiglio T, Gudas LJ: Overexpression of lecithin:retinol acyltransferase in the epithelial basal layer makes mice more sensitive to oral cavity carcinogenesis induced by a carcinogen. In: Cancer Biol. Ther.. 8, Nr. 13, Juli 2009, S. 1212–3. PMID 19471114. Volltext bei PMC: 2882701.
Wikimedia Foundation.


 +
+