- Veresterung
-
Die Veresterung (auch Esterbildung) ist eine Gleichgewichts- und Kondensationsreaktion, bei der ein Alkohol oder Phenol mit einer Säure zu einem Ester reagiert. Die Säurekomponente kann eine organische Carbonsäure (z. B. Essigsäure, Benzoesäure, Zitronensäure) oder eine anorganische Säure (z. B. Schwefelsäure, Salpetersäure, Phosphorsäure) sein.
Inhaltsverzeichnis
Veresterung von Carbonsäuren
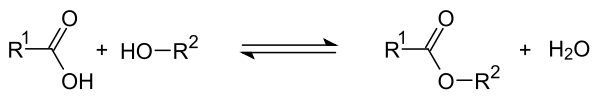
Ester entstehen, wenn ein Alkohol mit einer Carbonsäure in Gegenwart einer starken Säure als Katalysator (meist konzentrierte Schwefelsäure) reagiert. Dabei kommt es zu einer Additions- mit anschließender Eliminierungsreaktion.[1] Die Rückreaktion bezeichnet man als saure Esterhydrolyse oder Esterspaltung. Die Reaktionsgleichung der Veresterung einer Carbonsäure kann so dargestellt werden:
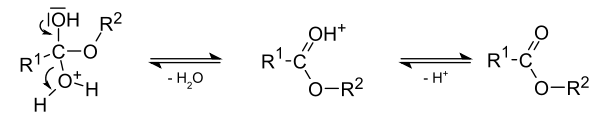
Mechanismus der säurekatalysierten Veresterung (Fischer-Veresterung)
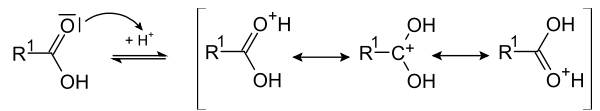
Emil Fischer hat als Erster erkannt, dass die Veresterung am besten in saurem Milieu vonstatten geht. Der erste Schritt ist die Protonierung der Carbonsäure zu einem mesomeriestabilisierten Kation.
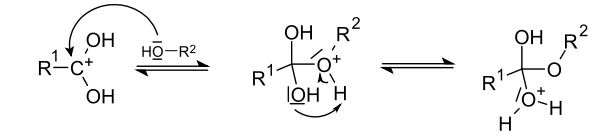
Das durch die Protonierung gebildete Kation wird von einem freien Elektronenpaar der Hydroxygruppe des Alkohols nukleophil angegriffen. Das Wasserstoffatom des ursprünglichen Alkanols bildet eine intramolekulare Wasserstoffbrückenbindung zu einem Sauerstoffatom der Carboxygruppe aus und geht mit diesem schließlich eine Bindung ein.
Das oben im letzten Schritt entstandene Oxoniumion spaltet zunächst Wasser zu einem Kation ab, das nach Deprotonierung den Ester ergibt.
Dieser Mechanismus konnte durch Isotopenmarkierung des Sauerstoffatoms im Alkohol bewiesen werden.[2]
Mit Alkoholen, die leicht Kationen bilden, wie z. B. tertiären, werden jedoch Ester gebildet, bei denen beide Sauerstoffatome aus der Carbonsäure stammen. Hier wird die Säure an das Kation angelagert und spaltet anschließend ein Proton ab.
Weitere Veresterungsreaktionen
Es gibt eine Reihe weiterer Möglichkeiten, Alkohole und Säuren bzw. Säurederivate zu Estern umzusetzen, so z. B. die Reaktion zwischen Alkohol und Säurechlorid (Schotten-Baumann-Methode), Alkohol und Säureanhydrid, die Steglich-Veresterung oder die Mitsunobu-Reaktion. Die Umesterung erlaubt den Austausch der alkoholischen oder Säurekomponente eines vorhandenen Esters.
Esterspaltung
Die Rückreaktion der Veresterung ist die saure Esterhydrolyse (siehe Hydrolyse). Die basische oder alkalische Esterhydrolyse hat einen anderen Reaktionsmechanismus als die saure und ist deswegen unter Verseifung explizit dargestellt.
Einzelnachweise
- ↑ Siegfried Hauptmann: Reaktion und Mechanismus in der organischen Chemie, B. G. Teubner, Stuttgart, 1991, S. 161−162, ISBN 3-519-03515-4.
- ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag Wien und New York (1972), S. 73−74, ISBN 3-211-81060-9.
Wikimedia Foundation.