- Optogenetik
-
Die Optogenetik ist ein relativ neues Fachgebiet, das sich mit der Kontrolle von genetisch modifizierten Zellen mittels Licht beschäftigt.
Inhaltsverzeichnis
Beschreibung
Es handelt sich bei dieser Technologie mithin um eine Kombination von Methoden der Optik und der Genetik, mit dem Ziel bestimmte funktionelle Ereignisse in spezifischen Zellen oder lebenden Geweben an- (gain-of-function) oder abzuschalten (loss-of-function). Hierbei werden lichtsensitive Proteine auf gentechnischem Wege durch Manipulation der kodierenden DNA (= des entsprechenden Gens) verändert und anschließend in bestimmte Zielzellen bzw. -gewebe eingebracht. Unter Lichteinfluss ist es anschließend möglich das Verhalten der in dieser Weise modifizierten Zellen zu kontrollieren.
Die Optogenetik erlaubt mit anderen Worten eine gezielte und überaus schnelle (Millisekundenbereich) Kontrolle von exakt definierten Ereignissen in komplexen biologischen Systemen.[1] Möglich werden hierdurch Untersuchungen auf Proteinebene (Anwendungen in der Molekularbiologie), auf Ebene von einzelnen Zellen (Zellbiologie) und definierten Geweben (Histologie) oder sogar auf Ebene von sich frei bewegenden Säugetieren (Verhaltensbiologie).
Die von der Wissenschaftszeitschrift Nature Methods zur „Methode des Jahres 2010“ erkorene Technologie wird bei Tieren bereits zur Behandlung von Parkinson und Epilepsie erprobt.[1][2][3]
Optogenetische Verfahren werden heute schon genutzt, um unterschiedlichste intrazelluläre Prozesse, wie z. B. die Lokalisation von Proteinen in bestimmten Regionen der Zelle oder die Produktion spezifischer Moleküle wie Second Messenger (sekundäre Botenstoffe) zu erforschen bzw. zu kontrollieren.[4] Durch diese gezielte Modifizierung der zellulären Signalkaskaden erfährt die Zellbiologie derzeit einen Erkenntniszuwachs über intrazelluläre Abläufe, wie er noch vor einigen Jahren kaum vorstellbar war. Auch in der Neurologie, wo das Verfahren erstmals entwickelt wurde, ermöglicht es bislang undenkbar detaillierte Einblicke in die Arbeitsweise des Nervensystems und des Gehirns.[2]
Channelrhodopsin als Beispiel für einen optogenetischen Schalter
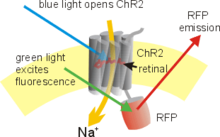 Schematische Darstellung eines ChR2-RFP-Fusions-Proteins. RFP ist eine rot leuchtende Variante des Grün fluoreszierenden Proteins (GFP)
Schematische Darstellung eines ChR2-RFP-Fusions-Proteins. RFP ist eine rot leuchtende Variante des Grün fluoreszierenden Proteins (GFP)
Ein Beispiel wie die Optogenetik auf molekularer Ebene eingesetzt wird ist die Verwendung einer genetisch modifizierten Form des Channelrhodopsins (ChR2) als „Schalter“-Molekül. Channelrhodopsine sind von Natur aus eigenständige, lichtgesteuerte Ionenkanäle. Sie sind trotz struktureller Verwandtheit keine so genannten G-Protein-gekoppelten Rezeptoren. Es ist nun möglich, das in den Intrazellularraum hineinreichende C-terminale Ende des ChR2-Proteins zu ersetzen oder zu verändern (modifizieren), ohne dass die Funktion des Proteins als Ionenkanal beeinträchtigt wird. Die genetisch modifizierten Fusions-Proteine können anschließend mit Hilfe einer Reihe von Transfektionstechniken (virale Transfektion, Elektroporation, Genkanone) in erregbaren Zellen wie Neuronen eingebracht und dort zur Expression (Produktion) gebracht werden. Vitamin A, die Vorstufe des lichtabsorbierenden Chromophors Retinals ist in Wirbeltier-Zellen meist schon vorhanden, so dass sich erregbare Zellen, die ein Channelrhodopsin exprimieren, durch Beleuchtung einfach depolarisieren lassen. Dies erlaubt wiederum den Einsatz von modifizierten Channelrhodopsinen, beispielsweise für Anwendungen wie die Photostimulation von Neuronen. Das blauempfindliche ChR2 in Kombination mit der durch Gelblicht-aktiviertierbaren Chlorid-Pumpe Halorhodopsin erlauben das An- und Abschalten der neuronalen Aktivität innerhalb von Millisekunden.[5]
Wird ChR2 mit einem Fluoreszenzlabel markiert, können durch Licht angeregte Axone und Synapsen im intakten Gehirngewebe identifiziert werden.[6] Diese Technik lässt sich zur Aufklärung der molekularen Ereignisse während der Induktion synaptischer Plastizität einsetzen.[7] Mit Hilfe von ChR2 wurden weitreichende neuronale Bahnen im Gehirn kartiert.[8]
Dass sich das Verhalten transgener Tiere, die ChR2 in einem Anteil ihrer Neuronen exprimieren, durch intensive Beleuchtung mit Blaulicht berührungslos kontrollieren lässt, wurde bereits für Nematoden, Taufliegen, Zebrafisch und Mäuse gezeigt.[9][10]
Dieser Abschnitt ist in weiten Teilen dem Artikel Channelrhodopsin#Anwendungen in der Forschung entnommen (siehe ebenda).
Einzelnachweise
- ↑ a b Karl Deisseroth: Optogenetics. In: Nature Methods. 8, Nr. 1, 2011, S. 26–29, doi:10.1038/nmeth.f.324, PMID 21191368.
- ↑ a b Im Licht der Zellen. Zeit Online. Abgerufen am 26. Januar 2011.
- ↑ Special Feature: Method of the Year 2010. Nature. Abgerufen am 26. Januar 2011.
- ↑ Jared E Toettcher, Christopher A Voigt, Orion D Weiner, Wendell A Lim: The promise of optogenetics in cell biology: interrogating molecular circuits in space and time. In: Nature Methods. 8, Nr. 1, 2011, S. 35–38, doi:10.1038/nmeth.f.326, PMID 21191368.
- ↑ Feng Zhang, Li-Ping Wang, Martin Brauner, Jana F. Liewald, Kenneth Kay, Natalie Watzke, Phillip G. Wood, Ernst Bamberg, Georg Nagel, Alexander Gottschalk, Karl Deisseroth: Multimodal fast optical interrogation of neural circuitry. In: Nature. 446, Nr. 7136, 5. März 2007, S. 633–639, doi:10.1038/nature05744, PMID 17410168.
- ↑ Yan-Ping Zhang, Thomas G Oertner: Optical induction of synaptic plasticity using a light-sensitive channel. In: Nat Meth. 4, Nr. 2, Januar 2007, S. 139–141, doi:10.1038/nmeth988, PMID 17195846.
- ↑ Yan-Ping Zhang, Niklaus Holbro, Thomas G. Oertner: Optical induction of plasticity at single synapses reveals input-specific accumulation of αCaMKII. In: Proceedings of the National Academy of Sciences. 105, Nr. 33, 2008, S. 12039–12044, doi:10.1073/pnas.0802940105, PMID 18697934.
- ↑ Leopoldo Petreanu, Daniel Huber, Aleksander Sobczyk, Karel Svoboda: Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. In: Nat Neurosci. 10, Nr. 5, 15. April 2007, S. 663–668, doi:10.1038/nn1891, PMID 17435752.
- ↑ Adam D. Douglass, Sebastian Kraves, Karl Deisseroth, Alexander F. Schier, Florian Engert: Escape Behavior Elicited by Single, Channelrhodopsin-2-Evoked Spikes in Zebrafish Somatosensory Neurons. In: Current Biology. 18, Nr. 15, 5. Juli 2008, S. 1133–1137, doi:10.1016/j.cub.2008.06.077, PMID 18682213.
- ↑ Daniel Huber, Leopoldo Petreanu, Nima Ghitani, Sachin Ranade, Tomas Hromadka, Zach Mainen, Karel Svoboda: Sparse optical microstimulation in barrel cortex drives learned behaviour in freely moving mice. In: Nature. 451, Nr. 7174, 2008, S. 61–64, doi:10.1038/nature06445, PMID 18094685.
Weblinks
Kategorien:- Molekularbiologie
- Biologische Untersuchungsmethode
- Interdisziplinäre Wissenschaft
- Biophysik
Wikimedia Foundation.
