- Kanalrhodopsin
-
Channelrhodopsin —
Bezeichner Gen-Name(n) ChR1, ChR2, VChR1 Transporter-Klassifikation TCDB 3.E.1.7 Bezeichnung ionenverschiebendes mikrobielles Rhodopsin Vorkommen Übergeordnetes Taxon Algen Channelrhodopsine (deutsch auch: Kanalrhodopsine) sind Transportproteine, deren Leitfähigkeit für bestimme Ionen durch Licht gesteuert (engl. light-gated) wird. Channelrhodopsine ermöglichen dadurch die Beeinflussung des pH-Werts im Cytosol, des Calcium-Imports und die elektrische Erregbarkeit von Zellen durch einfallendes Licht.
Bisher (Stand 2008) sind drei Channelrhodopsine bekannt: Channelrhodopsin-1 (ChR1) und Channelrhodopsin-2 (ChR2) sind lichtgesteuerte Protonenkanäle und dienen Grünalgen der Gattung Chlamydomonas als sensorische Photorezeptoren; sie steuern negative und positive phototaxische Reaktionen bei hohem Lichteinfall. Channelrhodopsin-2 kann darüber hinaus für Kationen (positiv geladene Ionen) durchlässig werden. VChR1 wurde in der vielzelligen Alge Volvox gefunden; sein Absorptionsmaximum liegt bei einer höheren Wellenlänge als ChR1 und ChR2. Es zeigt aber 80 Prozent Homologie zur ChR1-Gruppe.[1]
Inhaltsverzeichnis
Aufbau und Funktion
Channelrhodopsinen wird ein mit Rhodopsin vergleichbarer Aufbau aus sieben helicalen Transmembrandomänen zugeschrieben. Als Chromophor ist das durch Licht isomerisierbare all-trans-Retinal, ein Vitamin A-Abkömmling, im Inneren des Proteinmoleküls kovalent gebunden. Während die meisten G-Protein-gekoppelten Rezeptoren (darunter Rhodopsin) Ionenkanäle indirekt mittels sekundäre Botenstoffen öffnen, bildet bei den Channelrhodopsinen das Protein selbst eine Pore. Dieser Aufbau ermöglicht eine sehr schnelle und zuverlässige Depolarisation der Zelle. Das Absorptionsmaximum von ChR2 liegt mit ungefähr 460 nm im Blauen. Im Zusammenspiel mit der Chlorid-Pumpe Halorhodopsin, die durch gelbes Licht aktiviert wird und Neurone inhibiert, erlaubt der Einsatz von ChR2 die optische Aktivierung und Abschaltung der Neuronenaktivität durch Beleuchtung mit verschiedenfarbigem Licht.
Channelrhodopsine (ChR) sind, wie andere Rhodopsine auch, helikale Proteine mit sieben Transmembrandomänen und einem Retinal-Chromophor, der als protonierte Schiffsche Base kovalent an das Protein gebunden ist. Das Absorptionsmaximum von ChR2 liegt mit ungefähr 460-470 nm im Blauen. Sobald das all-trans Retinal im Protein-Retinal-Komplex Licht absorbiert isomerisiert es zu einem 13-cis-Retinal und verursacht dadurch eine Konformationsänderung des Proteins. Diese führt über zum Öffnen der Pore im Protein, ihr Durchmesser beträgt mindestens 0,6 nm. Das 13-cis-Retinal relaxiert nach einiger Zeit zurück zum all-trans-Retinal, wodurch sich die Pore wieder schließt und der Ionenfluss unterbrochen wird.[2] Der Aufbau aus sieben Transmembrandomänen wie er bei Channelrhodopsin-2 gefunden wurde, kommt nur selten bei Ionenkanälen vor, die meist aus gleichartigen Untereinheiten zusammengesetzt sind.[2]
Anwendungen in der Forschung
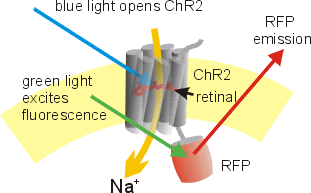 Schematische Darstellung eines ChR2-RFP Fusions-Proteins. RFP ist eine rot leuchtende Variante des Grün fluoreszierenden Proteins (GFP)
Schematische Darstellung eines ChR2-RFP Fusions-Proteins. RFP ist eine rot leuchtende Variante des Grün fluoreszierenden Proteins (GFP)Während der N-Terminus die sieben Transmembrandomänen einschließt, reicht das C-terminale Ende des ChR2 Proteins in den Intrazellularraum hinein und kann ersetzt oder verändert werden, ohne dass die Funktion des Proteins als Ionenkanal beeinträchtigt wird. Channelrhodopsine können mit einer Reihe von Transfektionstechniken (virale Transfektion, Elektroporation, Genkanone) in erregbaren Zellen wie Neuronen exprimiert (produziert) werden. Vitamin-A, die Vorstufe des lichtabsorbierenden Chromophors Retinals ist in Wirbeltier-Zellen meist schon vorhanden, so dass erregbare Zellen, die ein Channelrhodopsin exprimieren, durch Beleuchtung einfach depolarisiert lassen.
Aufgrund dieser Eigenschaften interessieren sich Biotechnik und Neurowissenschaften für den Einsatz von Channelrhodopsinen, beispielsweise für Anwendungen wie die Photostimulation von Neuronen. Das blauempfindliche ChR2 in Kombination mit der durch Gelblicht-aktiviertierbaren Chlorid-Pumpe Halorhodopsin erlauben das An- und Abschalten der neuronalen Aktivität innerhalb von Millisekunden.[3] Das neu entstehende Fachgebiet, dass sich mit der Kontrolle von genetisch modifizierten Zellen mittels Licht beschäftigt, wird als Optogenetik bezeichnet.
Wird ChR2 mit einem Fluoreszenzlabel markiert, können durch Licht angeregte Axone und Synapsen im intakten Gehirngewebe identifiziert werden.[4] Diese Technik lässt sich zur Aufklärung der mokularen Ereignisse während der Induktion synaptischer Plastizität einsetzen.[5] Mit Hilfe von ChR2 wurden weitreichende neuronale Bahnen im Gehirn kartiert.[6]
Dass sich das Verhalten transgener Tiere, die ChR2 in einem Anteil ihrer Neuronen exprimieren, durch intensive Beleuchtung mit Blaulicht berührungslos kontrollieren lässt, wurde bereits für Nematoden, Taufliegen, Zebrafisch und Mäuse gezeigt.[7][8]
Die Sehfunktion blinder Mäuse konnte durch Expression von ChR2 in Bipolarzellen der Netzhaut im Auge teilweise wieder hergestellt werden.[9] Vorstellbar ist auch eine zukünftige medizinische Verwendung von ChR2 bei bestimmten Formen der retinalen Degeneration oder zur Stimulation tief liegender Gehirnabschnitte.
Einzelnachweise
- ↑ Zhang F, Prigge M, Beyrière F, et al: Red-shifted optogenetic excitation: a tool for fast neural control derived from Volvox carteri. In: Nat. Neurosci.. 11, Nr. 6, April 23, 2008, S. 631–3. doi:10.1038/nn.2120. PMID 18432196
- ↑ a b Nagel G, Szellas T, Huhn W, et al: Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. In: Proc. Natl. Acad. Sci. U.S.A.. 100, Nr. 24, November 25, 2003, S. 13940–5. doi:10.1073/pnas.1936192100. PMID 14615590
- ↑ Zhang F, Wang LP, Brauner M, et al: Multimodal fast optical interrogation of neural circuitry. In: Nature. 446, Nr. 7136, April 5, 2007, S. 633–9. doi:10.1038/nature05744. PMID 17410168
- ↑ Zhang YP, Oertner TG: Optical induction of synaptic plasticity using a light-sensitive channel. In: Nat. Methods. 4, Nr. 2, February 4, 2007, S. 139–41. doi:10.1038/nmeth988. PMID 17195846
- ↑ Zhang YP, Holbro N, Oertner TG: Optical induction of plasticity at single synapses reveals input-specific accumulation of αCaMKII. In: Proc. Natl. Acad. Sci. U.S.A.. 105, August 19, 2008, S. 12039–44. doi:10.1073/pnas.0802940105. PMID 18697934
- ↑ Petreanu L, Huber D, Sobczyk A, Svoboda K: Channelrhodopsin-2–assisted circuit mapping of long-range callosal projections. In: Nat. Neurosci.. 10, Nr. 5, May 1, 2007, S. 663–8. doi:10.1038/nn1891. PMID 17435752
- ↑ Douglass AD, Kraves S, Deisseroth K, Schier AF, Engert F: Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. In: Current Biology. 18, Nr. 15, August 5, 2008, S. 1133-7. PMID 18682213
- ↑ Huber D, Petreanu L, Ghitani N, Ranade S, Hromádka T, Mainen Z, Svoboda K: Sparse optical microstimulation in barrel cortex drives learned behaviour in freely moving mice. In: Nature. 451, Nr. 7174, Jan 3, 2008, S. 61-4. PMID 18094685
- ↑ Lagali PS, Balya D, Awatramani GB, et al: Light-activated channels targeted to ON bipolar cells restore visual function in retinal degeneration. In: Nat. Neurosci.. 11, Nr. 6, June 1, 2008, S. 667–75. doi:10.1038/nn.2117. PMID 18432197
Weiterführende Literatur
- Arenkiel BR, Peca J, Davison IG, et al: In vivo light-induced activation of neural circuitry in transgenic mice expressing channelrhodopsin-2. In: Neuron. 54, Nr. 2, April 2007, S. 205–18. doi:10.1016/j.neuron.2007.03.005. PMID 17442243 (Einsatz Channelrhodopsin in transgenen Mäusen zur Erforschung der neuronalen Verschaltung im Gehirn)
- Bi A, Cui J, Ma YP, et al: Ectopic expression of a microbial-type rhodopsin restores visual responses in mice with photoreceptor degeneration. In: Neuron. 50, Nr. 1, April 2006, S. 23–33. doi:10.1016/j.neuron.2006.02.026. PMID 16600853 (Channelrhodopsin als mögliche Behandlung von Blindheit)
Weblinks
Wikimedia Foundation.
