- Silbercarbonat
-
Strukturformel 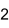
![\mathrm{ \ \!\ \Biggr]}](6/2c6110b020ae0c3cfe64f3748f9aea9a.png)
Allgemeines Name Silbercarbonat Andere Namen Silber(I)-carbonat
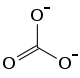
Summenformel Ag2CO3 CAS-Nummer 534-16-7 Kurzbeschreibung hellgelbes Pulver[1]
Eigenschaften Molare Masse 275,75 g·mol−1 Aggregatzustand fest
Dichte 6,08 g·cm−3 (20 °C)[2]
Schmelzpunkt Löslichkeit schlecht in Wasser (32 mg·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Gefahr
H- und P-Sätze H: 318 EUH: keine EUH-Sätze P: 260-305+351+338-313 [1] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 MAK 0,01 mg·m−3[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Silbercarbonat ist eine chemische Verbindung des Silbers aus der Gruppe der Carbonate.
Inhaltsverzeichnis
Gewinnung und Darstellung
Silbercarbonat lässt sich durch Fällung aus silberhaltigen Lösungen, beispielsweise von Silbernitrat, durch Alkalimetallcarbonate wie Natriumcarbonat gewinnen.[6]
Eigenschaften
Neu hergestelltes Silbercarbonat ist weiß und verfärbt sich schnell gelblich. Wie viele Silberverbindungen ist es lichtempfindlich und sollte daher im Dunklen aufbewahrt werden. Es kristallisiert im monoklinen Kristallsystem. Beim Erhitzen über 218 °C zersetzt es sich unter Abgabe von Kohlenstoffdioxid.[3]
Während die Verbindung in Wasser nur schlecht löslich ist, löst sie sich gut in Säuren wie Salpetersäure oder Schwefelsäure, Kaliumcyanidlösung sowie in Kaliumcarbonatlösungen, wobei sich Doppelsalze bilden.[6]
Verwendung
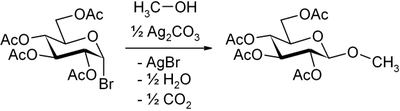
Silbercarbonat findet in der organischen Synthesechemie Verwendung. Wird es auf Kieselgur aufgetragen, wirkt es als Oxidationsmittel. Eine bedeutende Rolle spielt die Verbindung in der Koenigs-Knorr-Methode. Hierbei werden aus halogensubstituierten Monosaccharid-Derivaten selektiv 1,2-trans-Glycoside gewonnen. Durch das Silber wird das Halogen gefällt, und es kann mit Alkoholen ein Glycosid gebildet werden.[6]
Weiterhin wird es für die Gewinnung von Silberpulver[3] und für die Abtrennung von Chlorid, Bromid und Iodid bei der ionenchromatographischen Bestimmung von Anionen in Salzwasser genutzt.[7]
Einzelnachweise
- ↑ a b c d e f Datenblatt Silbercarbonat bei Merck, abgerufen am 20. Mai 2010.
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics. 90. Auflage. Taylor & Francis, 2009, ISBN 978-1-4200-9084-0, Kap. 4, S. 88.
- ↑ a b c Andreas Brumby et.al.: Silver, Silver Compounds, and Silver Alloys. In: Ullmann's Encyclopedia of Industrial Chemistry. 6. Auflage, Wiley-VCH, Weinheim 2008, doi:10.1002/14356007.a24 107.pub2.
- ↑ a b Gigiena Truda i Professional'nye Zabolevaniya. (Labor Hygiene and Occupational Diseases). Vol. 27(12), Pg. 33, 1983.
- ↑ a b Silbercarbonat bei ChemIDplus.
- ↑ a b c Helmut Sitzmann: Silbercarbonat. In: Roempp Chemie-Lexikon. Thieme Verlag, Stand Juli 2009.
- ↑ Silbercarbonat (Jenachem)
Wikimedia Foundation.