- Vilazodon
-
Strukturformel 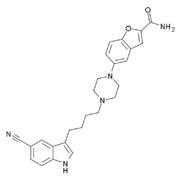
Allgemeines Freiname Vilazodon Andere Namen - 5-(4-(4-(5-Cyano-3-indolyl)butyl)-1-piperazinyl)benzofuran-2-carboxamid (IUPAC)
- Viibryd (Markenname)
Summenformel C26H27N5O2 CAS-Nummer - 163521-12-8
- 163521-08-2 (Hydrochlorid)
PubChem 6918313 ATC-Code N06AX24
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 441,52 g·mol−1 (freie Base) Aggregatzustand fest
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Vilazodon, Entwicklungscode EMD 68843 bzw. SB-659746, ist der internationale Freiname für ein verschreibungspflichtiges Antidepressivum. Der Wirkstoff wurde am 21. Januar 2011 von der US-amerikanischer Food and Drug Administration (FDA) zugelassen[2][3] und hat den Markennamen Viibryd.[4] Vilazodon kommt als Hydrochlorid in den Handel.
Inhaltsverzeichnis
Wirkungsweise
Vilazodon wirkt auf zweifache Weise. Primär ist es ein selektiver Serotonin-Wiederaufnahmehemmer und es wirkt außerdem als Partialagonist selektiv auf den 5-HT1A-Rezeptor.[5][6] Die Affinität zu den anderen 5-HT-Rezeptoren ist dagegen sehr gering.[6] Dieses Wirkprinzip ist bisher einzigartig.[7] Es kombiniert die Wirkmechanismen der bis dahin üblichen Erstlinientherapie (first-line therapy) mit der Zweitlinientherapie (second-line therapy).[8]
Nebenwirkungen
Vilazodon wird im Allgemeinen gut toleriert. Zu den wesentlichen Nebenwirkungen gehören Durchfall, Übelkeit und Kopfschmerz.[7] Im Gegensatz zu anderen Antidepressiva scheint Vilazodon keine Einflussnahme auf das Körpergewicht und die sexuellen Funktionen der Patienten zu haben (siehe auch: Serotonin-Wiederaufnahmehemmer#Unerwünschte Wirkungen).[9]
Entwicklungsgeschichte
Vilazodon wurde ursprünglich von der Merck KGaA entwickelt. Der Markteintritt war für 2005 geplant.[10] Die ursprüngliche maximale Dosis betrug 20 mg.[11] Im Februar 2001 vergab Merck eine Lizenz an GlaxoSmithKline. Beide Unternehmen wollten Vilazodon gemeinsam weiterentwickeln und nach der Zulassung vermarkten.[12][13] Die Substanz durchlief 15 Phase-I- und 5 Phase-II-Studien,[14] in denen kein gesicherter Nachweis für eine signifikante Wirksamkeit erbracht werden konnte.[15] Im September 2004 vergab Merck dann die weltweiten Exklusivrechte an das US-amerikanische Biotechnologieunternehmen Genaissance Pharmaceuticals.[16] Im Juni 2005 wurde Genaissance Pharmaceuticals von Clinical Data, Inc. übernommen.[17] Von Februar 2006 bis Mai 2007 wurde von Genaissance Pharmaceuticals mit Vilazodon eine Phase-III-Studie zur Ermittlung der Wirksamkeit und möglicher genetischer Marker durchgeführt.[18]
Die Firma Trovis Pharmaceuticals, LLC (ehemals PGxHealth, LLC), eine 100%ige Tochtergesellschaft von Clinical Data,[19] führte von März 2008 bis März 2009 eine randomisierte plazebokontrollierte Doppelblindstudie (Phase III) mit Vilazodone und einer Dosis von 40 mg Wirkstoff durch.[20] Eine offene Phase-III-Studie lief von Dezember 2007 bis Mai 2009.[21] In diesen Studien konnte ein Nachweis der Wirksamkeit erbracht werden, was zur Zulassung von Vilazodone durch die FDA führte.
Im April 2011 wurde Clinical Data von Forest Laboratories übernommen.[22][23]
Pharmakologische Eigenschaften
Vilazodone wird peroral verabreicht und hat eine Plasmahalbwertszeit von 20 bis 24 Stunden. Der berechnete Oktanol-Wasser-Verteilungskoeffizient beträgt 3,48.[24] Die Bioverfügbarkeit liegt bei ca. 72 %.[25]
Weiterführende Literatur
- A. Khan, A. J. Cutler, D. K. Kajdasz, S. Gallipoli, M. Athanasiou, D. S. Robinson, H. Whalen, C. R. Reed: A randomized, double-blind, placebo-controlled, 8-week study of vilazodone, a serotonergic agent for the treatment of major depressive disorder. In: The Journal of clinical psychiatry Band 72, Nummer 4, April 2011, S. 441–447, ISSN 1555-2101. doi:10.4088/JCP.10m06596. PMID 21527122.
- L. A. Dawson, J. M. Watson: Vilazodone: a 5-HT1A receptor agonist/serotonin transporter inhibitor for the treatment of affective disorders. In: CNS neuroscience & therapeutics Band 15, Nummer 2, 2009, S. 107–117, ISSN 1755-5949. PMID 19499624. (Review).
- R. Adamec, G. D. Bartoszyk, P. Burton: Effects of systemic injections of vilazodone, a selective serotonin reuptake inhibitor and serotonin 1A receptor agonist, on anxiety induced by predator stress in rats. In: European journal of pharmacology Band 504, Nummer 1–2, November 2004, S. 65–77, ISSN 0014-2999. doi:10.1016/j.ejphar.2004.09.009. PMID 15507223.
- T. Heinrich, H. Böttcher, R. Gericke, G. D. Bartoszyk, S. Anzali, C. A. Seyfried, H. E. Greiner, C. Van Amsterdam: Synthesis and structure–activity relationship in a class of indolebutylpiperazines as dual 5-HT(1A) receptor agonists and serotonin reuptake inhibitors. In: Journal of medicinal chemistry Band 47, Nummer 19, September 2004, S. 4684–4692, ISSN 0022-2623. doi:10.1021/jm040793q. PMID 15341484.
- D. Treit, A. Degroot, S. Kashluba, G. D. Bartoszyk: Systemic EMD 68843 injections reduce anxiety in the shock-probe, but not the plus-maze test. In: European journal of pharmacology Band 414, Nummer 2–3, März 2001, S. 245–248, ISSN 0014-2999. PMID 11239925.
- H. Murck, R. M. Frieboes, I. A. Antonijevic, A. Steiger: Distinct temporal pattern of the effects of the combined serotonin-reuptake inhibitor and 5-HT1A agonist EMD 68843 on the sleep EEG in healthy men. In: Psychopharmacology Band 155, Nummer 2, Mai 2001, S. 187–192, ISSN 0033-3158. PMID 11401008.
- E. A. Rabiner, R. N. Gunn, M. R. Wilkins, P. A. Sargent, E. Mocaer, E. Sedman, P. J. Cowen, P. M. Grasby: Drug action at the 5-HT(1A) receptor in vivo: autoreceptor and postsynaptic receptor occupancy examined with PET and [carbonyl-(11)C]WAY-100635. In: Nuclear medicine and biology Band 27, Nummer 5, Juli 2000, S. 509–513, ISSN 0969-8051. PMID 10962259.
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ fda.gov: FDA Approved Drug Products Abgerufen am 20. Mai 2011.
- ↑ K. Traynor: Vilazodone approved for major depression. In: American journal of health-system pharmacy Band 68, Nummer 5, März 2011, S. 366, ISSN 1535-2900. doi:10.2146/news110009. PMID 21330672.
- ↑ fda.gov: Application Number: 022567 - Orig1s000 Proprietary Name Review(s). vom 15. November 2010.
- ↑ G. D. Bartoszyk, R. Hegenbart, H. Ziegler: EMD 68843, a serotonin reuptake inhibitor with selective presynaptic 5-HT1A receptor agonistic properties. In: European journal of pharmacology Band 322, Nummer 2–3, März 1997, S. 147–153, ISSN 0014-2999. PMID 9098681.
- ↑ a b M. E. Page, J. F. Cryan, A. Sullivan, A. Dalvi, B. Saucy, D. R. Manning, I. Lucki: Behavioral and neurochemical effects of 5-(4-[4-(5-Cyano-3-indolyl)-butyl)-butyl]-1-piperazinyl)-benzofuran-2-carboxamide (EMD 68843): a combined selective inhibitor of serotonin reuptake and 5-hydroxytryptamine(1A) receptor partial agonist. In: The Journal of pharmacology and experimental therapeutics Band 302, Nummer 3, September 2002, S. 1220–1227, ISSN 0022-3565. doi:10.1124/jpet.102.034280. PMID 12183683. freier Volltext
- ↑ a b R. H. Howland: Vilazodone: another novel atypical antidepressant drug. In: Journal of psychosocial nursing and mental health services Band 49, Nummer 3, März 2011, S. 19–22, ISSN 0279-3695. doi:10.3928/02793695-20110203-98. PMID 21323263.
- ↑ Edgar Filing: CLINICAL DATA INC - Form 10-K. Vom 19. Juni 2007 S. 30.
- ↑ reuters.com: FDA approves Clinical Data Inc's antidepressant. Vom 21. Januar 2011.
- ↑ Focus on value and time to market: Clinical development pipeline set to fuel sustainable growth. Pressemitteilung der Merck KGaA vom 26. Oktober 2000.
- ↑ Center for Drug Evaluation and Research: APPLICATION NUMBER: 022567Orig1s000. S. 1. Abgerufen am 21. Mai 2011.
- ↑ GSK fills product gap by licensing Merck KGaA antidepressant. vom 16. Februar 2001.
- ↑ chemie.de: GlaxoSmithKline und Merck KGaA unterzeichnen weltweites Lizenzabkommen über ein neuartiges Antidepressivum. Vom 16. Februar 2001.
- ↑ Edgar Filing: CLINICAL DATA INC - Form 10-K. Vom 19. Juni 2007 S. 31.
- ↑ Edgar Filing: CLINICAL DATA INC - Form 10-K. Vom 19. Juni 2007 S. 65.
- ↑ Merck Kgaa lizenziert Vilazodone an Genaissance Pharmaceuticals aus. In: Handelsblatt vom 23. September 2004
- ↑ Clinical Data to aquire Genaissance Pharmaceuticals. Pressemitteilung vom 21. Juni 2005.
- ↑ clinicaltrials.gov: Effectiveness Study of Vilazodone to Treat Depression and to Discover Genetic Markers Associated With Response. Abgerufen am 20. Mai 2011.
- ↑ United States Securities and Exchange Commission: Form 8-K Current Report; CLINICAL DATA, INC. Vom 21. Januar 2011.
- ↑ clinicaltrials.gov: Randomized, Double-Blind, Placebo Controlled Study of Vilazodone's Efficacy, Safety, and Biomarkers of Response in Major Depressive Disorder (MDD). Abgerufen am 20. Mai 2011
- ↑ clinicaltrials.gov: A One Year Open Label Study Assessing the Safety and Tolerability of Vilazodone in Patients With Major Depressive Disorder (MDD). Abgerufen am 20. Mai 2011.
- ↑ Forest Laboratories will Clinical Data übernehmen. In: Ärzte Zeitung vom 9. März 2011.
- ↑ finanznachrichten.de: Forest Laboratories Completes Acquisition of Clinical Data, Inc.. vom 14. April 2011.
- ↑ chemexper.com: Vilazodone. Abgerufen am 20. Mai 2011.
- ↑ Center for Drug Evaluation and Research: APPLICATION NUMBER: 022567Orig1s000. Abgerufen am 21. Mai 2011.

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.
