- Cidofovir
-
Strukturformel 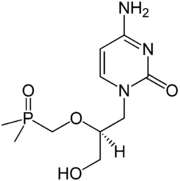
Allgemeines Freiname Cidofovir Andere Namen (S)-[1-(4-Amino-2-oxo-pyrimidin-1-yl)-3-hydroxy-
propan-2-yl]oxymethylphosphonsäureSummenformel C8H14N3O6P CAS-Nummer 113852-37-2 PubChem 60613 ATC-Code J05AB12
DrugBank APRD00148 Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: ja Eigenschaften Molare Masse 279,19 g·mol−1 Schmelzpunkt 260 °C [1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [2] 
Gefahr
H- und P-Sätze H: 301-315 EUH: keine EUH-Sätze P: 301+310 [2] EU-Gefahrstoffkennzeichnung [2]
T
GiftigR- und S-Sätze R: 25-38 S: 45-36-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cidofovir (Handelsname Vistide®, Hersteller: Gilead Sciences) ist ein azyklisches Nukleotidanalogon (Monophosphat) von Deoxycytidin-Monophosphat und gehört zur Gruppe der Virustatika. Es ist für die intravenöse Behandlung der CMV-Retinitis bei AIDS-Patienten zugelassen. Cidofovir hemmt die virale DNA-Polymerase zahlreicher DNA-Viren.
Verschiedentlich wurden Cremezubereitungen von Cidofovir versuchsweise zur Bekämpfung von HPV-Infektionen eingesetzt. Allerdings verfügen HPV-Viren über keine eigene DNA-Polymerase, aus diesem Grunde ist der exakte Wirkmechanismus von Cidofovir bei HPV-Infektionen derzeit noch unklar. In vitro führte Cidofovir zur Apoptose HPV-positiver Keratinozyten. In verschiedenen Studien mit wenigen Patienten führte die lokale Verabreichung von einprozentiger Creme oder Gel auf Condylomata acuminata zur Reduktion[3] oder zur kompletten Heilung bei über 50 Prozent der behandelten Patienten. Für therapierefraktäre multiple Verrucae vulgares oder Plantarwarzen wurden in Einzelfallberichten und in einer kleinen Studie mit ein- oder dreiprozentiger Cidofovir-Creme Heilungsraten von 90 bis 100 Prozent berichtet. Systemische Nebenwirkungen von Cidofovir wurden hierbei nicht beobachtet, es kam aber häufig zu lokalen Irritationen. Bei Patienten nach Lungentransplantation konnte Cidofovir zu akuten Nierenversagen führen.[4][5]
Rote-Hand-Brief
Der Hersteller macht darauf aufmerksam, dass Cidofovir nur zur intravenösen Infusion bestimmt ist und nicht auf andere Weise, einschließlich intraokularer Injektion oder topischer Anwendung, verabreicht werden darf. Hintergrund der Information sind Meldungen über unerwünschte Ereignisse wie Nephrotoxizität, Neutropenie und toxische Wirkungen am Auge im Zusammenhang mit nicht zugelassenen Formen der Applikation sowie Anwendung in nicht zugelassenen Indikationen. Es wird darauf hingewiesen, dass nur für die CMV-Retinitis bei Erwachsenen mit AIDS ein günstiges Nutzen-Risiko-Profil von Vistide® belegt ist.[6]
Einzelnachweise
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 377, ISBN 978-0-911910-00-1.
- ↑ a b c Datenblatt Cidofovir hydrate bei Sigma-Aldrich, abgerufen am 23. März 2011.
- ↑ Coremans G et al. Topical cidofovir (HPMPC) is an effective adjuvant to surgical treatment of anogenital condylomata acuminata. Dis Colon Rectum. 2003 Aug, PMID 12907906.
- ↑ Zedtwitz-Liebenstein K et al.Acute renal failure in a lung transplant patient after therapy with cidofovir. Transpl Int. 2001 Dec;14(6), PMID 11793044.
- ↑ Bulletin zur Arzneimittelsicherheit, Ausgabe 1; März 2011 Risiken durch den Off-Label-Gebrauch von Cidofovir (Vistide®).
- ↑ Arzneimittelkommission der deutschen Ärzteschaft Rote-Hand-Brief zu Vistide® (Cidofovir) (Gilead Sciences GmbH vom 12. Januar 2011).
Weblinks
- Vistide-Information der European Medicines Agency (PDF-Datei; 15 kB)
- Kapitel 38: Antiretrovirale und wichtige Medikamente in HIV 2010. Das Buch zu HIV und AIDS.
- Kapitel 2: Substanzklassen, Medikamentenübersicht in HIV 2010. Das Buch zu HIV und AIDS.

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.
