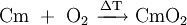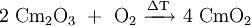- CmO2
-
Kristallstruktur 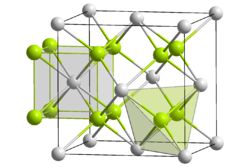
Cm4+: __ O2-: __ Kristallsystem kubisch Raumgruppe 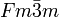
Gitterkonstanten a = 536 pm Koordinationszahlen Cm[8], O[4] Allgemeines Name Curium(IV)-oxid Andere Namen Curiumdioxid
Verhältnisformel CmO2 CAS-Nummer 12016-67-0 Kurzbeschreibung schwarzer Feststoff[1][2] Eigenschaften Molare Masse je nach Isotop: 270–284 g/mol Aggregatzustand fest
Schmelzpunkt 380 °C (Zersetzung)[3]
Sicherheitshinweise Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Curium(IV)-oxid ist ein Oxid des Elements Curium. Es besitzt die Summenformel CmO2.
Inhaltsverzeichnis
Vorkommen
Da alle Isotope des Curiums nur künstlich hergestellt sind, besitzt Curium(IV)-oxid keine natürlichen Vorkommen.
Darstellung
Curiumdioxid kann direkt aus den Elementen dargestellt werden. Hierzu wird metallisches Curium an Luft oder in einer Sauerstoffatmosphäre geglüht.[5]
Für Kleinstmengen bietet sich das Glühen von Salzen des Curiums an. Meistens werden hierzu Curium(III)-oxalat (Cm2(C2O4)3) oder Curium(III)-nitrat (Cm(NO3)3) herangezogen.
Eine weitere Möglichkeit stellt die Umsetzung von Curium(III)-oxid unter Sauerstoffatmosphäre bei 650 °C dar.[6]
Eigenschaften
Curium(IV)-oxid ist ein schwarzer Feststoff. Es kristallisiert im kubischen Kristallsystem in der Fluorit-Struktur in der Raumgruppe
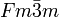 und die Koordinationszahlen sind Cm[8], O[4]. Der Gitterparameter beträgt 536 pm.[7] Die Bildungsenthalpie bei 25 °C wird auf 167 ± 5 J/(mol·K) geschätzt.[8]
und die Koordinationszahlen sind Cm[8], O[4]. Der Gitterparameter beträgt 536 pm.[7] Die Bildungsenthalpie bei 25 °C wird auf 167 ± 5 J/(mol·K) geschätzt.[8]Reaktionen
Die Verbindung beginnt ab etwa 380 °C sich zu zersetzen. Hierbei wird zunächst unter Sauerstoffabgabe eine Verbindung der Summenformel CmO1,95 gebildet, aus welcher ab 430 °C unter Reduktion Curium(III)-oxid entsteht.[3] Unter Sauerstoffatmosphäre ist Curiumdioxid jedoch auch bei höheren Temperaturen stabil (siehe auch Darstellung).
Einzelnachweise
- ↑ Lester R. Morss, Norman M. Edelstein, Jean Fuger, (Hrsg.): The Chemistry of the Actinide and Transactinide Elements: Bd. 3, 2006, Springer.
- ↑ Curium(IV)-oxid bei www.webelements.com.
- ↑ a b W. C. Mosley: "Phases and Transformations in the Curium-Oxygen System", in: J. Inorg. Nucl. Chem. 1972, 34 (2), 539–555; doi:10.1016/0022-1902(72)80434-2.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ L. B. Asprey, F. H. Ellinger, S. Fried, W. H. Zachariasen: "Evidence for Quadrivalent Curium: X-Ray Data on Curium Oxides", in: J. Am. Chem. Soc. 1955, 77 (6), 1707–1708; doi:10.1021/ja01611a108.
- ↑ M. Noé, J. Fuger: "Self-radiation effects on the lattice parameter of 244CmO2", in: Inorg. Nucl. Chem. Lett. 1971, 7 (5), 421–430; doi:10.1016/0020-1650(71)80177-0.
- ↑ J. C. Wallmann: "A Structural Transformation of Curium Sesquioxide", in: J. Inorg. Nucl. Chem. 1964, 26 (12), 2053–2057; doi:10.1016/0022-1902(64)80149-4.
- ↑ R. J. M. Konings: "Thermochemical and Thermophysical Properties of Curium and its Oxides", in: J. Nucl. Mater. 2001, 298 (3), 255–268; doi:10.1016/S0022-3115(01)00652-3.
Siehe auch
Wikimedia Foundation.