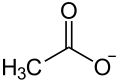
- Acetat
-
Als Acetate werden die Salze oder Ester der Essigsäure (Ethansäure) bezeichnet. Die salzartigen Acetate sind zumeist weiße, kristalline Feststoffe, die in ihren Kristallgittern (Ionengittern) das Acetat-Ion (CH3COO−) enthalten. Dieses ist das Säureanion der Essigsäure.
Beispiele für salzartige Acetate sind Natriumacetat (CH3COONa), Kaliumacetat (CH3COOK) oder Blei(II)-acetat ((CH3COO)2Pb).
Darstellung
Die salzartigen Acetate gewinnt man durch Neutralisation der Essigsäure mit Metallhydroxiden oder Metalloxiden:
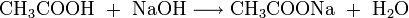
- Essigsäure und Natriumhydroxid reagieren zu Natriumacetat und Wasser.
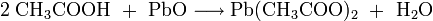
- Essigsäure und Blei(II)-oxid ergeben Bleiacetat und Wasser.
Die Essigsäureester enthalten als Säurerest den Acetylrest. Der bekannteste dieser Ester ist der Essigsäureethylester. Organische Acetate [CH3COOR] erhält man durch eine Veresterung der Essigsäure mit Alkoholen (R-OH):
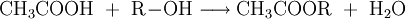
- Essigsäure und Alkohol reagieren zu einem Essigsäureester und Wasser.
Nachweis
In der chemischen Analytik können Acetate leicht nachgewiesen werden, indem man die Probe mit Kaliumhydrogensulfat im Mörser zerreibt. Dabei wird das Proton (H+) des Hydrogensulfat-Ions auf das Acetation übertragen, wobei die flüchtige Essigsäure entsteht, die leicht durch ihren typischen Geruch identifiziert werden kann:
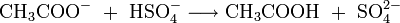
- Acetat wird durch Hydrogensulfat protoniert. Es entsteht Essigsäure und Sulfat.
Wikimedia Foundation.