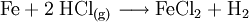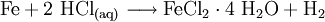- Eisendichlorid
-
Kristallstruktur 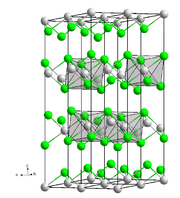
__ Fe2+ __ Cl- Allgemeines Name Eisen(II)-chlorid Andere Namen - Ferrochlorid
- Eisendichlorid
- Eisenchlorür
Verhältnisformel FeCl2
FeCl2 · 4 H2OCAS-Nummer 7758-94-3
13478-10-9ATC-Code B03AA05
Kurzbeschreibung farblose Kristalle, als Tetrahydrat gelb bis dunkelgrün Eigenschaften Molare Masse 126,75 g·mol−1
198,83 g·mol−1Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 1026 °C [1]
Dampfdruck Löslichkeit gut löslich in Wasser: 685 g·l–1 (20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-38-41 S: 26-39 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 450 mg/kg (oral, Ratte) [2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Eisen(II)-chlorid (FeCl2) ist eine chemische Verbindung von Eisen(II)- und Chlorid-Ionen. Eisen(II)-chlorid gehört zur Gruppe der Eisenhalogenide. Daneben existiert auch ein kristallwasserhaltiges Eisen(II)-chlorid-Tetrahydrat. Eisen(II)-chlorid-Tetrahydrat ist nicht durch Erhitzen in wasserfreies Eisen(II)-chlorid umzuwandeln, da sich beim Erhitzen zersetzt und Eisen(II)-oxid bildet.
Unter die Bezeichnung Eisenchlorid fällt auch das Eisen(III)-chlorid (FeCl3).
Gewinnung und Darstellung
Eisen(II)-chlorid wird durch Reaktion von Eisen mit trockenem Chlorwasserstoffgas hergestellt.
Dagegen kann man wasserfreies Eisen(II)-chlorid nicht durch Auflösen von Eisen in Salzsäure und anschließende Fällung erzeugen. Dabei entsteht das wasserhaltige Eisen(II)-chlorid-Tetrahydrat FeCl2 · 4 H2O und molekularer Wasserstoff:
Außerdem entsteht es als Nebenprodukt bei der Herstellung von Titandioxid nach dem Chloridverfahren. Beim Beizen von Eisenblechen und -teilen, als vorbereitendem Schritt der Verzinkung, fallen große Mengen an.
Verwendung
Im Labor und in der Synthesechemie ist Eisen(II)-chlorid ein wichtiger Ausgangsstoff zur Herstellung von weiteren Eisenverbindungen wie Eisen(III)-chlorid.
Bei der Abwasserreinigung dient es als Fäll- und Flockungsmittel. So verwenden beispielsweise Kläranlagen häufig Eisen(II)-chlorid zur Phosphatelimination, das heißt zur Ausfällung von Phosphaten (Waschmittel- bzw Spülmittelbestandteile). Beste Ergebnisse werden bei der Simultanfällung erreicht.
Bei langen Abwasserkanalstrecken und Abwasserdruckleitungen kommt es in den wärmeren Jahreszeiten immer wieder zu Geruchsproblemen. Ursache ist die Bildung von Schwefelwasserstoff. Diese Bildung kann mit Eisen(II)-chlorid verhindert werden.
Biogasanlagen haben ebenfalls mit der Bildung von Schwefelwasserstoff zu kämpfen. Hier wird Eisen(II)-chlorid zur Biogasentschwefelung eingesetzt.
Neben der festen Form wird Eisen(II)-chlorid als wässrige Lösung im gummierten Tankwagen oder in Kannen vom Chemiehandel ausgeliefert. Seit kurzem findet die Verbindung auch Verwendung in der Raumfahrt.
Quellen
Wikimedia Foundation.