- Exothermie
-
Als exotherm bezeichnet man in der Chemie Reaktionen, bei denen Energie in Form von Wärme, Licht, Bewegungsenergie o. ä. an die Umgebung abgegeben wird.
Typische exotherme Reaktionen sind
- Verbrennung fossiler oder nachwachsender Brennstoffe,
- die Knallgasreaktion.
Exotherm, wenn auch in weit geringerem Maße, verläuft oft auch das Mischen von Stoffen (Mischungswärme) oder die Adsorption und Absorption von Stoffen etwa an Aktivkohle oder Zeolithen.
Bezeichnet ΔH die Differenz der Enthalpien der End- (H2) und Ausgangsstoffe (H1), also die aufgenommene Energie, gilt für exotherme Reaktionen ΔH = H2 − H1 < 0.
Auch in der Physik bezeichnet man eine Kernreaktion, bei der Energie frei wird, als exotherm. Eine exotherme Kernfusion ist etwa das Wasserstoffbrennen, wie es in der Sonne geschieht.
Das Gegenteil zur exothermen Reaktion ist die endotherme Reaktion.
Ablauf einer exothermen Reaktion
Die Edukte befinden sich zunächst in einem metastabilen Zustand. Durch kurze Zufuhr eines bestimmten Energiebetrags, der Aktivierungsenergie (Aktivierungsenthalpie), wird das System in den instabilen Zustand gehoben. Durch die Aktivierung kommt die Reaktion in Gang und läuft ohne weitere Energiezufuhr selbständig ab. In der Gesamtbilanz gibt das chemische System Energie an die Umgebung ab, sie wird als Reaktionsenthalpie bezeichnet. Die Produkte befinden sich jetzt in einem stabilen Zustand. (Zur Stabilität von Systemen siehe auch Systemeigenschaften)
Beispiel: Kohle verbrennt mit dem Sauerstoff der Luft unter Wärmeentwicklung zu Kohlenstoffdioxid.
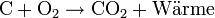
-
- Die Reaktionsenthalpie (Enthalpiedifferenz) ΔH dieser Reaktion ist negativ. Sie lässt sich aus den Standardbildungsenthalpien berechnen.
Ist die Aktivierungsenergie sehr niedrig, kann die Reaktion bereits ohne zusätzliche Energiezufuhr von außen in Gang gesetzt werden. Die notwendige Aktivierungsenergie wird der Umgebung entzogen. Die Reaktion läuft spontan ab.
Abgrenzung
Wenn man von einem exothermen Vorgang spricht wird keine Aussage darüber getroffen ob eine Reaktion freiwillig abläuft. Hier unterscheidet man dann zwischen exergonen und endergonen Reaktionen.
Wikimedia Foundation.

