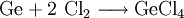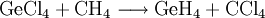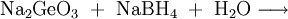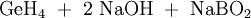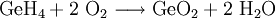- Germaniumhydrid
-
Strukturformel 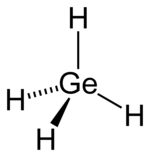
Allgemeines Name Monogerman Andere Namen Germaniumwasserstoff, Germaniumtetrahydrid
Summenformel GeH4 CAS-Nummer 7782-65-2 Kurzbeschreibung farb- und geruchloses Gas Eigenschaften Molare Masse 76,62 g·mol-1 Aggregatzustand gasförmig[1]
Dichte 3,45 kg/m3 bei 0°C und 1013 mbar[1], 1,38 g/cm3 im flüssigen Zustand am Siedepunkt[1]
Schmelzpunkt -165,98 °C[1]
Siedepunkt Löslichkeit Hydrolyse in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Hoch-
entzündlichSehr giftig (F+) (T+) R- und S-Sätze R: 12-17-26 S: (1/2)-9-16-33-36-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Monogerman (GeH4) ist die einfachste chemische Verbindung aus der Gruppe der Germane (eine Verbindung aus Germanium und Wasserstoff). Es ist ein sehr reaktionsfreudiges, giftiges, leicht zersetzliches und geruchloses Gas und findet Anwendung in der Halbleitertechnologie.
Inhaltsverzeichnis
Vorkommen
Monogerman wurde in der Jupiteratmosphäre nachgewiesen.[2]
Gewinnung und Darstellung
Monogerman entsteht bei der Zersetzung salzartiger Germanide (Germanium-Metallverbindungen) in Säuren, wie zum Beispiel Magnesiumgermanid in Bromwasserstoffsäure:
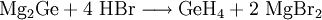 .
.
Monogerman kann auch durch direkte Reaktion von Germanium mit Wasserstoff dargestellt werden, wobei auch andere Germaniumhydride (Germane) wie Germaniumhexahydrid/Digerman (Ge2H6) und Germaniumoctahydrid/Trigerman (Ge3H8) entstehen. Leichter und mit hoher Reinheit gelingt die Synthese von Monogerman durch die Reaktion von Germaniumtetrachlorid mit Methan und Palladium als Katalysator. Die Ausbeute beträgt dabei 98 %, als Nebenprodukt entsteht Tetrachlormethan:
Im Labormaßstab kann Monogerman auch durch Reaktion von Germanium(IV)-Verbindungen mit Hydriden gewonnen werden. Eine typische Synthese dieser Art ist Na2GeO3 mit Natriumborhydrid
Eigenschaften
Monogerman hat eine kritische Temperatur von 34,85 °C, einen kritischer Druck von 55,5 Bar und eine kritische Dichte von 0,598 kg/l.
Verwendung
Monogerman wird in der Elektronik-Industrie zur Epitaxie und zum Dotieren verwendet.
Sicherheitshinweise
Schon ab einem Anteil von ca. 10,1 % bildet Monogerman stark explosionsfähige Gemische mit Luft. Da das Gas sehr schwer ist und sich normalerweise nur bis zu 5 % in der Luft anreichert, ist es nur als hochentzündlich einzustufen. Monogerman ist sehr giftig. Bei einer akuten Vergiftung mit großen Mengen Monogerman treten die folgenden Symptome auf:
Ursache hierfür ist die Unterbrechung des Sauerstofftransports, da Monogerman mit dem im Blut transportierten Sauerstoff zu Germanium(IV)-oxid und Wasser reagiert:
Verhindert werden kann dies durch Gabe von Komplexbildnern wie beispielsweise EDTA.
Quellen
Wikimedia Foundation.