- Alkanthiol
-
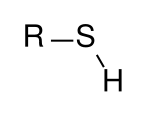
Alkanthiole (kurz als Thiole bezeichnet) sind organische Verbindungen, die eine oder mehrere Thiolgruppen (SH-Gruppen) als funktionelle Gruppen tragen. Alkanthiole entsprechen Alkoholen, deren Sauerstoffatom durch ein Schwefelatom ersetzt ist. Wie sich die Alkohole formal vom Wasser (H2O) ableiten, sind die Alkanthiole Abkömmlinge des Schwefelwasserstoffs (H2S).
Inhaltsverzeichnis
Nomenklatur
Alkanthiole werden auch Thioalkohole oder, wegen ihrer Eigenschaft, Quecksilber-(II)-Ionen zu binden, Mercaptane genannt (von lat. Mercurium captans: Quecksilber fangend). Die Namen einzelner Alkanthiole werden aus dem entsprechenden Namen des Alkans und der Endsilbe -thiol gebildet, wie beispielsweise Methanthiol, Ethanthiol usw. Darüber hinaus haben viele Alkanthiole Trivialnamen, z. B. Ethylmercaptan für Ethanthiol.
Eigenschaften
Chemische Eigenschaften
Als Homologe der Alkohole – Schwefel steht in der gleichen Hauptgruppe wie Sauerstoff – gehen Alkanthiole ähnliche Reaktionen ein. Ihre Salze heißen Thiolate; die Anionen sind gute Nukleophile. Weiterhin sind sie Reduktionsmittel, die beispielsweise vielfach in der Proteinchemie eingesetzt werden.
Die im Vergleich zur O-H-Bindung schwächere S-H-Bindung führt dazu, dass Thioalkohole stärker sauer sind als die analogen Alkohole und bereits in wässriger NaOH-Lösung Thiolate bilden. Ferner lassen sich Thiole im Gegensatz zu Alkoholen oxidativ zu Disulfiden dimerisieren; dies ist wichtig bei Proteinen, in denen zwei Aminosäure-Ketten über Cystein-Einheiten verknüpft sein können.
Physikalische Eigenschaften
Thioalkohole sieden niedriger als die analogen Alkohole, da Schwefel aufgrund der geringeren Elektronegativität zum Wasserstoff keine Wasserstoffbrückenbindungen bildet.
Toxizität
Alkanthiole sind erkennbar an ihrem besonders widerwärtigen Geruch. Sie haben eine toxische Wirkung auf das Zentralnervensystem.
Vorkommen
Als Aromastoffe findet man Alkanthiole u. a. in Milch, Käse, Zwiebeln und Knoblauch. Sie werden bei Abbau- und Fäulnisprozessen von organischem Material frei. Alkanthiole wie But-2-en-1-thiol kommen auch im Drüsensekret des Stinktiers vor. Weitere Beispiele für das natürliche Vorkommen von Mercaptanen sind Rohöl und das Kondensat aus der Erdgasgewinnung. Das Erdgaskondensat aus dem von Qatar und dem Iran erschlossenem Gasfeld South Pars kann bis zu 3000 ppm Mercaptane enthalten.
Beispiele für Alkanthiole
Methanthiol (Methylmercaptan), Ethanthiol (Ethylmercaptan), Propanthiol, Dithiothreitol (DTT), Dithioerythritol (DTE)
Anwendung
Besonders lineare Thiole wie Hexadecanthiol finden in neuerer Zeit verstärkt Anwendung beim Aufbau von selbstorganisierende Monoschichten (Self Assembling Monolayers, SAM). Die hohe Affinität der Thiolgruppe zu Münzmetallen, insbesondere Gold, führt dazu, dass sich die Thiole spontan in einer hochgeordneten Schicht zusammenlagern, wenn ein Goldsubstrat einer Thiollösung exponiert wird. Wenn die Thiole geeignet funktionalisiert sind, wie zum Beispiel mit ssDNA oder Proteinen, bildet dieses System die Grundlage für Biosensoren (Biacore).
Darüber hinaus werden Brenngasen wie Erdgas oder Campinggas Gemische aus Methanthiol, Ethanthiol, Propan-1-thiol und 2-Methyl-propan-2-thiol (tert.-Butylmercaptan, TBM) als Odorierungsmittel beigemengt. Sie erzeugen "Gasgeruch", da Erdgas bzw. Methan selbst geruchlos sind, und tragen zur sicheren Verwendung dieser Brennstoffe bei. Ein Beispiel dafür ist die unbeabsichtigte Freisetzung des Odorierungsmittels am 16. Januar 2001 im Stadtlabor von Bern, wonach die Altstadt wegen Gasgeruchs für den Verkehr gesperrt wurde[1]. Ein weiteres oft verwendetes Odoriermittel ist Tetrahydrothiophen (THT), das jedoch nicht zur Verbindungsklasse der Alkanthiole zählt.
Einzelnachweise
Weblinks
Wikimedia Foundation.