- Heterologes Enzym
-
Rekombinant hergestellte Proteine sind Eiweiße, die mit Hilfe von gentechnisch veränderten (Mikro-)Organismen hergestellt werden. Seit dem Beginn der Entwicklung der Gentechnik wurde eine Vielzahl bakterieller Organismen, Pilzen oder Säugetierzellen für die Herstellung von Fremdproteinen, insbesondere von pharmazeutischen Proteinen, etwa von Insulin oder Impfstoffen genutzt. Bevorzugte Systeme für eine derartige Produktion sind das Darmbakterium Escherichia coli, verschiedene Hefearten und Säugetierzellen – dabei meistens Hamsterzellen.
Ein für die gentechnische Produktion von Proteinen genutztes System sollte verschiedene Voraussetzungen erfüllen: Es sollte in der Lage sein, schnell in großen Fermentern möglichst kostengünstig zu wachsen. Es sollte die gewünschten Substanzen effizient produzieren, wenn möglich, ins Medium ausschleusen (sezernieren). Es sollte insbesondere für die Produktion von Pharmazeutika hohen Sicherheitsanforderungen genügen und die Proteine in einer authentischen, möglichst „menschlichen“ Form produzieren.
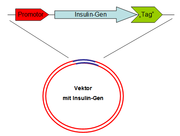
Am einfachsten wird die Information für das Protein in einen Vektor kloniert, ein Plasmid, das dann in den Wirtsorganismus, transformiert oder transfiziert wird.
Im Folgenden werden die grundlegenden Vorgehensweisen der Proteinüberexpression anhand des Beispiels „Insulin“ beschrieben:
Inhaltsverzeichnis
Klonierung und Transformation
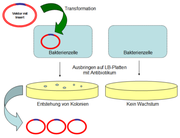
Um ein Bakterium dazu zu bewegen, das menschliche Protein Insulin herzustellen, muss man ihm die Bauanleitung dafür zur Verfügung stellen. Dies geschieht, indem man das Insulin-Gen in die Bakterienzelle einschleust. Mit dem Gen allein kann die Zelle aber nichts anfangen. Deshalb bringt man das Insulin-Gen vorher in einen Vektor, der alle wichtigen Informationen enthält, damit das Gen abgelesen werden kann. Er wird von den Bakterien erkannt, vermehrt und bei einer Zellteilung an die Tochterzellen weitergegeben. Im Artikel Klonierung ist beschrieben, wie ein solcher Vektor mit Gen-Insert hergestellt wird.
Der Vektor enthält neben dem Insulin-Gen einen Promotor (im Bild rot), welcher als Startpunkt für die Ablesung des Gens (Transkription) fungiert. Meist ist der Promotor induzierbar; er wird also erst dann aktiv, wenn eine bestimmte Substanz zugegeben wird. Dies ermöglicht die Produktion des Proteins zu bestimmten Zeitpunkten oder ab einer bestimmten Zelldichte sowie die Produktion von Proteinen, die für die Bakterien eigentlich toxisch sind.
Am Anfang oder am Ende des Insulin-Gen befindet sich ein sogenannter tag (engl. für "Markierung"). Dieser tag dient der späteren Isolierung und Reinigung des Proteins. Tags bestehen aus kleinen Peptiden oder bestimmten Proteinen, die mit dem eigentlichen Protein fusioniert sind. Nach der Aufreinigung kann der tag abgespalten oder – wenn es die Funktion nicht beeinträchtigt – am exprimierten Protein belassen werden.
Der Vektor mit Insulin-Gen wird in E. coli-Bakterienzellen eingebracht (Transformation). Ein Antibiotikum-Resistenzgen auf dem Vektor sorgt dafür, dass nur die Zellen im Antibiotikum-haltigen Nährmedium wachsen, die den Vektor auch wirklich aufgenommen haben (Selektion).
Proteinsynthese und -aufschluss
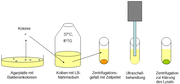
Eine Kolonie wird benutzt, um eine größere Menge Nährmedium anzuimpfen. Auch dieses Medium enthält Antibiotikum. Die resistenten Zellen vermehren sich im Nährmedium bei 37 °C durch Zweiteilung. Sobald eine bestimmte Bakterienzahl pro Milliliter Medium (OD ~ 0.9) erreicht ist, wird IPTG (Isopropyl-β-D-thiogalactopyranosid) zugegeben. Dieser Stoff dient als Induktor (siehe auch: Lactose-Operon): Das Insulin-Gen wird daraufhin abgelesen (Transkription), das Protein wird hergestellt (Translation).
Nachdem die Zellen einige Stunden lang Zeit für die Proteinsynthese hatten und Insulin im Zellinneren angereichert haben, werden die Bakterien "geerntet". Dazu überführt man das Nährmedium in Zentrifugationsgefäße und zentrifugiert bei geringer Drehzahl. Die Zellen setzen sich dabei am Boden des Röhrchens ab und bilden einen Klumpen (Pellet). Das Nährmedium kann abgegossen werden.
Da sich das überexprimierte Insulin noch in den Bakterienzellen befindet, müssen diese erst aufgeschlossen werden (Zellaufschluss). Eine weit verbreitete Methode ist die Ultraschall-Behandlung, die die Zellmembranen beschädigt und dazu führt, dass die Bakterien sich auflösen. Da in diesem Gemisch nun auch Proteinasen vorhanden sind, die normalerweise in abgetrennten Bereichen der Zellen arbeiten und defekte Proteine abbauen, ist es entscheidend, dass Proteinase-Hemmstoffe (Proteinase-Inhibitoren) zugegeben werden. Diese Hemmstoffe blockieren die proteinabbauende Wirkung der Proteinasen. Andernfalls würde das Insulin angegriffen und beschädigt werden.
Zur Entfernung von Zelltrümmern, nicht aufgeschlossenen Zellen und größeren Zellorganellen als Pellet wird der Aufschluss erneut zentrifugiert. Das klare Lysat kann nun dem entscheidenden Reinigungsschritt unterzogen werden: der Affinitätschromatographie.
Affinitätschromatografie
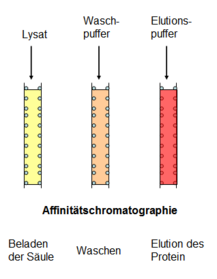
Im eigentlichen Schritt der Gewinnung des überexprimierten Insulins spielt der Affinitäts-Tag eine wichtige Rolle. Dieses Anhängsel besteht aus kleinen Peptiden (häufig Hexa-Histidin: His-Tag) oder einem Protein (Maltose-bindendes Protein (MBP), Glutathionyl-S-Transferase (GST)) und fungiert anschaulich als eine Öse, an der das Insulin aus der Lösung herausgefischt werden kann. Ohne diese Reinigungshilfe wäre es sehr aufwändig, das Zielprotein aus der Vielzahl unterschiedlicher Proteine in der Zellaufschlusslösung herauszufiltern.
Praktisch benutzt man für die Abtrennung des gewünschten Proteins eine Säule, also eine Röhre, die mit einer Gelmatrix gefüllt ist. An diese Matrix sind Moleküle gebunden, die spezifisch wie ein Schlüssel in das Schloss, also den Reinigungs-Tag, passen (Ni2+-NTA für His-tag; Maltose für MBP; Glutathion für GST). Lässt man nun das Zelllysat durch die Säule fließen, so bindet der Affinitäts-Tag mitsamt dem Insulin an die Matrix, während alle anderen Proteine unbeeinflusst am Säulenende wieder zum Vorschein kommen. Um dennoch anhaftende Proteine zu entfernen, spült man die Säule mit einer Waschlösung. Der festen Bindung des Tags tut das keinen Abbruch.
Um das gebundene Insulin nun wieder von der Säule abzulösen (Elution), bedient man sich eines Tricks: man lässt einen Elutionspuffer durch die Säule laufen, der den Bindungspartner des Affinitäts-Tags in sehr hoher Konzentration enthält. Dadurch wird erreicht, dass der Affinitäts-Tag bevorzugt einen der frei in Lösung vorkommenden Bindungspartner wählt, und sich somit von der Säulenmatrix löst.
Siehe auch
Wikimedia Foundation.