- Hexachloroplatin(IV)-säure
-
Strukturformel 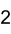


Allgemeines Name Hexachloridoplatin(IV)-säure Andere Namen - Chloridoplatinsäure
- Dihydrogenhexachloridoplatinat(IV)
Summenformel H2PtCl6 (wasserfreie Säure)
H2PtCl6 · 6 H2O (Hexahydrat)CAS-Nummer 16941-12-1 PubChem 61859 Kurzbeschreibung gelber bis rotbrauner, kristalliner Feststoff [1] Eigenschaften Molare Masse 517,90 g·mol−1 (Hexahydrat) Aggregatzustand fest
Dichte 2,43 g·cm−3
Schmelzpunkt 60 °C (Hexahydrat) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Giftig (T) R- und S-Sätze R: 25-34-42/43 S: (1/2)-22-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Hexachloridoplatinsäure H2[PtCl6] ist eine chemische Verbindung. Reine Hexachloridoplatinsäure ist eine gelbe bis schwach orangefarbene, stark hygroskopische, an der Luft zerfließliche Substanz. Bei oft minimal vorhandenen Iridium-Verunreinigungen variiert die Farbe von rot bis braun oder ist noch dunkler.
Inhaltsverzeichnis
Darstellung
Hexachloridoplatinsäure kann durch oxidative Auflösung von Platin in Königswasser dargestellt werden:
Aus wässriger Lösung entsteht dabei das Hexachloridoplatinsäure-Hexahydrat H2[PtCl6] · 6 H2O, welches sich bis zum Dihydrat entwässern lässt.[4] Darüber hinaus erfolgt ein Zerfall in Wasser, Salzsäure und Platintetrachlorid, da die Protonen der Oxonium-Ionen nach dem Entzug des Wassers keine geeignete Koordinationsstelle am [PtCl6]2−-Ion finden. Bei der Umsetzung der Säure mit Metallionen (Me= K, Rb, Cs, NH4+, Ag, Tl) wie Kalium, Rubidium, Cäsium, Ammonium, Silber und Thallium entstehen dabei schwerlösliche gelbe Niederschläge der allgemeinen Formel Me2[PtCl6].[4]
Verwendung
Hexachloridoplatinsäure ist Ausgangsverbindung zur Synthese platinhaltiger Zytostatika, z. B. Cisplatin, Oxaliplatin oder Carboplatin.
Siehe auch
Quellen
- ↑ a b Eintrag zu Hexachloridoplatinsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 10. Mai. 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 16941-12-1 im European chemical Substances Information System ESIS
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag 1999, ISBN 3-7776-0736-3
- ↑ a b Holleman-Wiberg: Lehrbuch der Anorganischen Chemie 91.–100. Auflage, Walter de Gruyter, Berlin 1985 ISBN 3-11-007511-3
Wikimedia Foundation.

![\mathrm{Pt + ( 3 \ HCl/HNO_3 ) \longrightarrow H_2[PtCl_6] + ... }](/pictures/dewiki/55/785b3b77cc8d8f75064de4b799204923.png)