- Indolamin-2,3-Dioxygenase
-
Indolamin-2,3-Dioxygenase —
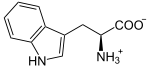
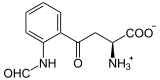
Vorhandene Strukturdaten: 2dot, 2dou Masse/Länge Primärstruktur 403 Aminosäuren Kofaktor Häm Bezeichner Gen-Name INDO Externe IDs OMIM: 147435 UniProt: P14902 Enzymklassifikation EC, Kategorie 1.13.11.52 Dioxygenase Reaktionsart Oxidation mit Einbau von zwei Sauerstoff-Atomen Substrat L-Tryptophan + O2 Produkte N-Formylkynurenin Vorkommen Homologie-Familie Indolamin-2,3-Dioxygenase Übergeordnetes Taxon Pilze, Tiere Indolamin-2,3-Dioxygenase (IDO) ist das Enzym, das Tryptophan zu N-Formylkynurenin abbaut. Im Gegensatz zur Tryptophan-2,3-Dioxygenase (TDO) wird IDO in allen Gewebetypen des menschlichen Körpers produziert, besonders aber in den Tonsillen und der Plazenta, wo der Abbau von Tryptophan einen über den normalen Katabolismus hinausgehenden Zweck hat: Unterstützung des Immunsystems bei Infektionen einerseits, und Verhinderung der Abstoßung des Fetus andererseits. Durch ihre immunsuppressive Wirkung ist sie ein vielversprechendes Target, um eine längere Akzeptanz von Transplantaten zu erreichen. Umgekehrt könnte ihre Hemmung die Tumorbekämpfung verbessern.[1][2][3]
Das INDO-Gen entstand wahrscheinlich durch Kopie des TDO2-Gens.[4]
Inhaltsverzeichnis
Katalysierte Reaktion
L-Tryptophan wird zu N-Formyl-L-kynurenin oxidiert. Als Substrat wird auch D-Tryptophan akzeptiert. Auch Superoxid kann als Sauerstoffdonor agieren.[5][6]
Funktionen im Immunsystem
Sowohl die immunsuppressive als auch die immununterstützende Funktion der IDO erklären sich aus dem hohen Wert der essentiellen Aminosäure Tryptophan, die besonders während der Aktivierung von T-Zellen, aber auch von eindringenden Fremdzellen benötigt wird. Mit dem rapiden Abbau allen Tryptophans durch IDO wird in der lokalen Umgebung die Proteinsynthese effektiv lahmgelegt. Zusätzlich aktivieren die entstehenden Abbauprodukte die Erzeugung regulatorischer T-Zellen, die letztendlich für die Immunsuppression verantwortlich sind.[7]
Immuntoleranz in Lymphknoten
Lymphknoten, die stromabwärts von einem Tumor liegen, sind sozusagen privilegiert; durch sie strömen besonders viele Tumorantigene. Es ist wichtig, dass in diesem Bereich die Immunantwort nicht überschießt, da sonst viel normales Gewebe darunter zu leiden hätte. Aus diesem Grund wird vom Körper in solchen Lymphknoten die Produktion von IDO verstärkt, um die Immunantwort zu dämpfen. Dies kann andererseits dazu führen, dass auch in Tumorgewebe verstärkt IDO produziert wird und dann Tumorantigene nicht mehr präsentiert und daher im weiteren Verlauf nicht als fremd erkannt werden. Tatsächlich wird IDO in mehreren Krebszelllinien überexprimiert. Man versucht daher, eine bessere Krebsbekämpfung durch Hemmung der IDO zu erreichen.[8]
Derselbe Mechanismus ist die Ursache, wenn chronische Infektionen lokales Tumorwachstum erleichtern, denn auch hier produzieren die stromabwärts gelegenen Lymphknoten unterhalb des Infektionsherds vermehrt IDO und verhindern dadurch eine vollständige Immunantwort durch T-Zellen. Mäuse mit verringerter IDO-Produktion zeigten dieses Phänomen nicht.[9]
Immuntoleranz in der Schwangerschaft
Die ursprüngliche Formulierung des Paradoxons, dass der Fetus nicht abgestoßen wird, geht auf Medawar zurück. Munn konnte am Mausmodell im Jahr 1998 zeigen, dass Hemmung der IDO mit 1-Methyltryptophan zu einer Abstoßung des Conceptus führt.[10][11][12]
Regulation
Die Produktion von IDO wird durch gamma-Interferon und Lipopolysaccharide hochgefahren. Die krebhemmende Wirkung von Curcumin ist zumindest teilweise auf die Unterbrechung dieses Signalwegs und folgende Hemmung der IDO zurückzuführen. Der Signalweg scheint auch eine Rolle bei der Etablierung einer HIV-Infektion zu spielen.[13][14][15]
Als Hemmstoffe von IDO sind 1-L-Methyltryptophan, das Alkaloid Exiguamin A und Derivate von Menadion bekannt.[16][17][18]
Einzelnachweise
- ↑ BioGPS Eintrag
- ↑ OMIM-Eintrag
- ↑ Quan J, Tan PH, MacDonald A, Friend PJ: Manipulation of indoleamine 2,3-dioxygenase (IDO) for clinical transplantation: promises and challenges. In: Expert Opin Biol Ther. 8, Nr. 11, November 2008, S. 1705–19. doi:10.1517/14712598.8.11.1705. PMID 18847306.
- ↑ Yuasa HJ, Takubo M, Takahashi A, Hasegawa T, Noma H, Suzuki T: Evolution of vertebrate indoleamine 2,3-dioxygenases. In: J. Mol. Evol.. 65, Nr. 6, Dezember 2007, S. 705–14. doi:10.1007/s00239-007-9049-1. PMID 18026683.
- ↑ UniProt P14902
- ↑ Werner ER, Werner-Felmayer G: Substrate and cofactor requirements of indoleamine 2,3-dioxygenase in interferon-gamma-treated cells: utilization of oxygen rather than superoxide. In: Curr. Drug Metab.. 8, Nr. 3, April 2007, S. 201–3. PMID 17430107.
- ↑ Chen W, Liang X, Peterson AJ, Munn DH, Blazar BR: The indoleamine 2,3-dioxygenase pathway is essential for human plasmacytoid dendritic cell-induced adaptive T regulatory cell generation. In: J. Immunol.. 181, Nr. 8, Oktober 2008, S. 5396–404. PMID 18832696.
- ↑ Katz JB, Muller AJ, Prendergast GC: Indoleamine 2,3-dioxygenase in T-cell tolerance and tumoral immune escape. In: Immunol. Rev.. 222, April 2008, S. 206–21. doi:10.1111/j.1600-065X.2008.00610.x. PMID 18364004.
- ↑ Muller AJ, Sharma MD, Chandler PR, et al: Chronic inflammation that facilitates tumor progression creates local immune suppression by inducing indoleamine 2,3 dioxygenase. In: Proc. Natl. Acad. Sci. U.S.A.. 105, Nr. 44, November 2008, S. 17073–8. doi:10.1073/pnas.0806173105. PMID 18952840.
- ↑ Medawar, P. B.: Some immunological and endocrinological problems raised by the evolution of viviparity in vertebrates. Symp. Soc. Exp. Biol. 7: 320-338, 1953.
- ↑ Billington WD: The immunological problem of pregnancy: 50 years with the hope of progress. A tribute to Peter Medawar. In: J. Reprod. Immunol.. 60, Nr. 1, Oktober 2003, S. 1–11. PMID 14568673.
- ↑ Munn DH, Zhou M, Attwood JT, et al: Prevention of allogeneic fetal rejection by tryptophan catabolism. In: Science (journal). 281, Nr. 5380, August 1998, S. 1191–3. PMID 9712583.
- ↑ Jeong YI, Kim SW, Jung ID, et al: Curcumin suppresses the induction of indoleamine 2,3-dioxygenase by blocking the JAK-PKC-delta -STAT1 signalling pathway in IFN-gamma -stimulated murine dendritic cells. In: J. Biol. Chem.. Dezember 2008. doi:10.1074/jbc.M807328200. PMID 19075017.
- ↑ Schroecksnadel K, Winkler C, Werner ER, et al: Interferon-gamma-mediated pathways and in vitro PBMC proliferation in HIV-infected patients. In: Biol. Chem.. November 2008. doi:10.1515/BC.2009.018. PMID 19040353.
- ↑ O'Connor JC, Lawson MA, André C, et al: Lipopolysaccharide-induced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice. In: Mol. Psychiatry. Januar 2008. doi:10.1038/sj.mp.4002148. PMID 18195714.
- ↑ Lob S, Konigsrainer A, Schafer R, Rammensee HG, Opelz G, Terness P: Levo- but not dextro-1-methyl tryptophan abrogates the IDO activity of human dendritic cells. In: Blood. 111, Nr. 4, Februar 2008, S. 2152–4. doi:10.1182/blood-2007-10-116111. PMID 18045970.
- ↑ Brastianos HC, Vottero E, Patrick BO, et al: Exiguamine A, an indoleamine-2,3-dioxygenase (IDO) inhibitor isolated from the marine sponge Neopetrosia exigua. In: J. Am. Chem. Soc.. 128, Nr. 50, Dezember 2006, S. 16046–7. doi:10.1021/ja067211+. PMID 17165752.
- ↑ Kumar S, Malachowski WP, DuHadaway JB, et al: Indoleamine 2,3-dioxygenase is the anticancer target for a novel series of potent naphthoquinone-based inhibitors. In: J. Med. Chem.. 51, Nr. 6, März 2008, S. 1706–18. doi:10.1021/jm7014155. PMID 18318466.
Weblinks
 Wikibooks: Biochemie und Pathobiochemie: Tryptophan-Stoffwechsel – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Tryptophan-Stoffwechsel – Lern- und Lehrmaterialien
Wikimedia Foundation.