- Tryptophan
-
Strukturformel 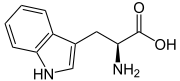
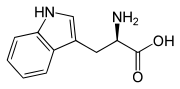
L-Tryptophan (oben) bzw. D-Tryptophan (unten) Allgemeines Freiname Tryptophan Andere Namen - L-Tryptophan
- (RS)-Tryptophan
- IUPAC: 2-Amino-3-(1H-indol-3-yl)propansäure
- Abkürzungen:
- Trp (Dreibuchstabencode)
- W (Einbuchstabencode)
Summenformel C11H12N2O2 CAS-Nummer - 73-22-3 (L-Tryptophan)
- 153-94-6 (D-Tryptophan)
PubChem 6305 ATC-Code N06AX02
DrugBank NUTR00058 Kurzbeschreibung weißer bis beigefarbener Feststoff[1]
Arzneistoffangaben Wirkstoffklasse - Antidepressiva
- Aminosäuren, inkl. Kombinationen mit Polypeptiden
- Lösungen zur parenteralen Ernährung
Wirkmechanismus Hormonvorstufe, Nahrungsmittel
Verschreibungspflichtig: Ja (teilweise) Eigenschaften Molare Masse 204,23 g·mol−1 Aggregatzustand fest
Schmelzpunkt - 290−295 °C (Zersetzung)[1]
- 257 °C (Hydrochlorid)[1]
Siedepunkt 281−282 °C (Sublimation bei 0,4 hPa)[1]
Dampfdruck pKs-Wert Löslichkeit Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tryptophan, abgekürzt Trp oder W, ist in der L-Form (siehe Fischer-Projektion) eine proteinogene α-Aminosäure (Synonym für L-Tryptophan: (S)-Tryptophan) mit einem aromatischen Indol-Ringsystem. Gemeinsam mit Phenylalanin, Tyrosin und Histidin zählt Tryptophan daher zu den aromatischen Aminosäuren. Es gehört zu den essentiellen Aminosäuren, kann also vom menschlichen Körper nicht gebildet und muss mit der Nahrung zugeführt werden. Das Enantiomer D-Tryptophan (Spiegelbild von L-Tryptophan) und das Racemat (Gemisch aus D- und L-Form) besitzen nur eine geringe Bedeutung.
Inhaltsverzeichnis
Vorkommen
Tryptophan ist Bestandteil von Proteinen und Peptiden. Da der menschliche Organismus nicht in der Lage ist, diese Aminosäure herzustellen, ist er auf die Zufuhr mit der Nahrung angewiesen. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Tryptophan am Gesamtprotein angegeben:[5]
Lebensmittel Gesamtprotein Tryptophan Anteil Sojabohnen 36,49 g 590 mg 1,6 % Cashew-Kerne 18,22 g 287 mg 1,6 % Kakaopulver, ungesüßt 19,60 g 293 mg 1,5 % Haferflocken 13,15 g 182 mg 1,4 % Kuhmilch, 3,7 % Fett 3,28 g 46 mg 1,4 % Reis, ungeschält 7,94 g 101 mg 1,3 % Hühnerei 12,57 g 167 mg 1,3 % Hähnchenbrustfilet, roh 21,23 g 267 mg 1,3 % Erbsen, getrocknet 24,55 g 275 mg 1,1 % Walnüsse 15,23 g 170 mg 1,1 % Schweinefleisch, roh 20,95 g 220 mg 1,1 % Lachs, roh 20,42 g 209 mg 1,0 % Mais-Vollkornmehl 6,93 g 49 mg 0,7 % Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 3,5 bis 6 mg Tryptophan pro Kilogramm Körpergewicht.[6] Es gibt Hinweise darauf, dass der Tryptophan-Bedarf individuell sehr verschieden ausfallen kann.[7]
Eigenschaften
Die Aminosäuren-Seitenkette von Tryptophan ist lipophil und aromatisch. Daher ist es schlecht wasserlöslich. Sein isoelektrischer Punkt liegt bei 5,89, der pKCOOH ist 2,4, der pKNH2 9,3 (beide bei 25 °C).
Das van-der-Waals-Volumen von Tryptophan ist 163 und der Hydrophobizitätsgrad −0,9. Freies Tryptophan als auch proteingebundene Tryptophan-Einheiten fluoreszieren unter Ultraviolettstrahlung. Bei Anregung mit UV-Licht mit einer Wellenlänge von 280 nm erfolgt die Fluoreszenzemission zwischen 308 bis 350 nm abhängig von der Polarität der direkten Umgebung von Tryptophan. Falls in Proteinen Tryptophan-Einheiten vorhanden sind, überdeckt die Fluoreszenz von Tryptophan die Fluoreszenz der übrigen aromatischen Aminosäuren (Tyrosin, Phenylalanin).
Gewinnung und Darstellung
Biosynthese
Pflanzen und Mikroorganismen können L-Tryptophan herstellen, unter anderem aus der Shikimisäure bzw. Anthranilsäure.[8] Letzteres kondensiert mit Phosphoribosylpyrophosphat (PRPP) unter Abspaltung von Diphosphat. Nach Umlagerung des Ribosanteils und einer folgenden Decarboxylierung nebst Dehydratisierung entsteht schließlich Indol-3-glycerinphosphat, was zu Indol gespalten wird. Im letzten Schritt katalysiert die Tryptophan-Synthetase[9] die Bildung von Tryptophan ausgehend von Indol und Serin.
Industrielle Synthese
Die industrielle Produktion von L-Tryptophan geschieht ebenfalls biosynthetisch aus L-Serin und Indol und nutzt dazu eine Wildtypmutante von Escherichia coli. Die Umsetzung wird dabei durch das Enzym Tryptophansynthase katalysiert.[9]
Verwendung
Arzneimittel/Nahrungsergänzung/Ernährung
Als Bestandteil von Nährlösungen [Aminoplasmal® (D), Aminosteril®-N-Hepa (D)] zur parenteralen Ernährung findet L-Tryptophan, neben anderen Aminosäuren, breite Anwendung.
Wirkung
Die Wirkung von L-Tryptophan wird oft als stimmungsaufhellend, beruhigend und gewichtsreduzierend beschrieben. Die stimmungsaufhellende Wirkung von L-Tryptophan beruht dabei vermutlich auf der Tatsache, dass es im menschlichen Körper zu Serotonin umgewandelt wird. Es wird angenommen, dass durch einen erhöhten Serotoninspiegel die Stimmung aufgehellt und Depressionen gelindert werden können. Als Nebenwirkungen können dabei vor allem Tagesmüdigkeit, Schwindel und Kopfschmerzen auftreten.
Die Plasmahalbwertszeit beträgt 2 ±0,1 Stunden; bei Lebererkrankungen wie Leberzirrhose kann diese auf 4,7 ±0,4 h ansteigen.[10]
Pharmakologie
L-Tryptophan gilt als „natürliches Antidepressivum“, ihm wird eine gute Wirksamkeit bei depressiven Erkrankungen bei gleichzeitig geringen Nebenwirkungen nachgesagt.
Als schlichte Nahrungsergänzung ist L-Tryptophan nur bei gesichertem Mangel sinnvoll, der in Industrieländern praktisch unbekannt ist. Bei einer Fruktosemalabsorption ist jedoch ein signifikant erniedrigter Serumtryptophanspiegel beobachtet worden.[11] Der Spiegel dieser essentiellen L-Aminosäure, dem Vorläufer des Serotonins, in der Nährflüssigkeit des Gehirns, ist nicht beliebig durch Verzehr entsprechend eiweißhaltiger Nahrung zu bewerkstelligen, denn L-Tryptophan konkurriert mit fünf anderen Aminosäuren an der Blut-Hirn-Schranke um das Eindringen in die Nährflüssigkeit des Gehirns; nämlich mit den verzweigtkettigen (das sind L-Valin, L-Leucin und L-Isoleucin) und zwei aromatischen (L-Phenylalanin und L-Tyrosin) Aminosäuren.[12] Dennoch lässt sich durch schlichte Nahrungsaufnahme der L-Tryptophanspiegel heben, indem man längere Zeit nach der letzten Mahlzeit eine durchaus bescheidene Menge eiweißreicher Kost verzehrt. L-Tryptophan kann als eine der wenigen nicht verzweigtkettigen Aminosäuren angesehen werden, die in einer Zeit geringen Nahrungsangebots nicht von den „gierigen“ Muskeln des Körpers aufgenommen werden. Die Aminosäure übersteigt dann bei geringer Konkurrenz anderer Aminosäuren leicht die Blut-Hirn-Schranke. Damit ist eine Voraussetzung für die ausreichende Bildung des wichtigen Hormons und Botenstoffes Serotonin auch in Hungerperioden gegeben.
Im Prinzip ist es möglich, statt L-Tryptophan auch L-5-Hydroxytryptophan einzunehmen, das wesentlich effizienter zu Serotonin verstoffwechselt werden soll, so dass die Dosis reduziert werden kann.
Dosierung
Zu einer Überdosierung von L-Tryptophan kommt es nur schwerlich, da L-Tryptophan selbst der Hauptaktivator seines abbauenden Enzyms Tryptophan-Pyrrolase (genauer: Tryptophan-2,3-Dioxygenase) ist.[13] Ein weiterer Aktivator ist Cortisol. Dies liefert auch eine Erklärung dafür, dass Stress (und der dadurch erhöhte Cortisolspiegel) zu einem verminderten Umsatz von L-Tryptophan zu 5-HTP führt. Nicotinsäure (Vitamin-B3) hingegen hemmt die Aktivität des Enzyms und fördert so den Umsatz von L-Tryptophan zu 5-HTP. Tryptophan-Pyrrolase baut L-Tryptophan unter Sauerstoffverbrauch zu N-Formyl-L-Kynurenin ab, welches in weitere Stoffe umgewandelt werden kann (u. a. Nicotinsäure). Dies ist auch der Hauptstoffwechselweg von L-Tryptophan (nur etwa 3 % wird zu 5-HTP bzw. Serotonin umgewandelt. Dabei fungiert Häm (Eisen) als Cofaktor. Einer Erhöhung der Zufuhr von L-Tryptophan steht ab einer gewissen Grenze eine überproportionale Aktivierung der Tryptophan-Pyrrolase gegenüber, so dass im Ergebnis mehr L-Tryptophan abgebaut wird, als zusätzlich zugeführt worden ist.[12]
Rechtliche Situation
L-Tryptophan ist in Deutschland zur Behandlung von depressiven Erkrankungen verschreibungspflichtig,[14] als milde Schlaf- und Beruhigungsmittel dürfen Tryptophan-haltige Arzneimittel ohne Rezept abgegeben werden (Dosis: 250 und 500 mg L-Tryptophan als Tablette oder Pulver in variablen Packungsgrößen). In Österreich sowie in der Schweiz ist L-Tryptophan rezeptpflichtig.[15]
L-Tryptophan war bis Januar 1996 in den Vereinigten Staaten verboten. Das Verbot geht zurück auf die Verwendung von verunreinigtem L-Tryptophan des japanischen Unternehmens Showa Denko in den 1980er Jahren. Die unreine Substanz enthielt u. a. ‚dimere‘ Tryptophan-Derivate, war gentechnisch hergestellt worden und soll für das Auftreten von Fällen des EMS-Syndroms (Eosinophilie-Myalgie-Syndrom) mit teilweise tödlichem Ausgang verantwortlich gewesen sein.[16]
Futtermittel
Viele Getreidesorten weisen einen zu geringen Gehalt einer essentiellen Aminosäure auf. Durch diesen Mangel an nur einer Aminosäure sinkt die Verwertbarkeit aller aufgenommenen Aminosäuren auf den durch die in zu geringer Menge enthaltene essentielle Aminosäure („limitierende Aminosäure“)[17] bestimmten Wert. Man steigert den Nährwert des Getreides dann durch den gezielten Zusatz geringer Mengen jener essentieller Aminosäuren, die darin defizitär sind. Der Zusatz von L-Tryptophan zu Mischfuttern ist in der Futtermittel-Industrie verbreitet.[18]
Biologische Bedeutung
Das Codon UGG codiert die Aminosäure Tryptophan.
- L-Tryptophan ist am Aufbau von diversen Proteinen im menschlichen Körper beteiligt, z. B. in den Muskeln, im Apolipoprotein B100 (Teil des Cholesterin-Transportmoleküls LDL) oder in Enzymen.
- Es dient als Vorläufer für verschiedene Botenstoffe (Neurotransmitter, Hormone) wie Serotonin und Melatonin.
- L-Tryptophan ist Provitamin für Vitamin B3.
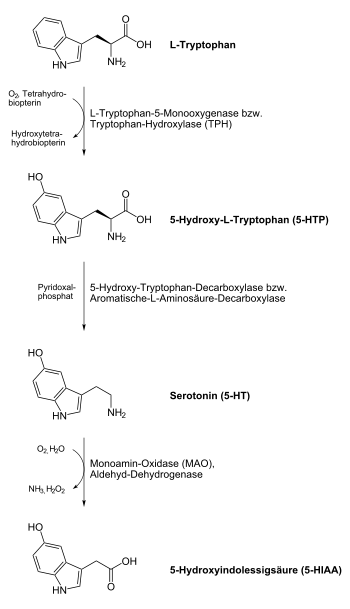
Serotoninsynthese (Mensch)
L-Tryptophan wird durch das Enzym Tryptophan-Hydroxylase (TPH)[19] in 5-Hydroxytryptophan (5-HTP) überführt. Die Tryptophanhydroxylase kann durch eine Reihe an Faktoren gehemmt werden, so z. B. durch Vitamin-B6- / Vitamin-B3-Mangel, Insulinresistenz, Magnesiummangel, aber auch durch Stress. Da der Übergang vom L-Tryptophan zum 5-HTP bei der körpereigenen Serotoninsynthese der geschwindigkeitsbestimmende Schritt ist, kommt der Tryptophan-Hydroxylase eine wichtige Regelfunktion dieses Syntheseweges zu.
5-HTP (auch bekannt unter dem Namen Oxitriptan) wird durch das Enzym Hydroxytryptophan-Decarboxylase (genauer: Aromatische-L-Aminosäure-Decarboxylase, AADC) [20] in Serotonin überführt. Das Vitamin-B6-Derivat Pyridoxalphosphat wirkt dabei als Cofaktor und verstärkt (oder vermindert) in Abhängigkeit seines Vorhandenseins die Aktivität der Hydroxytryptophan-Decarboxylase.[21]
Abbau von Tryptophan
Der Abbau von L-Tryptophan erfordert die Spaltung beider aromatischer Ringe, was durch Oxygenasen katalysiert wird. Dabei wird durch die Tryptophan-2,3-Dioxygenase zunächst der Pyrrolring aufgebrochen, wodurch über die Abspaltung von Ameisensäure (mithilfe der Arylformamidase) Kynurenin entsteht. Dieses wird durch die Kynurenin-3-Monooxygenase[22], zu 3-Hydroxykynurenin umgesetzt. Cofaktor ist dabei FAD, Cosubstrate molekularer Sauerstoff und NADPH. Nach Abspaltung von Alanin (mittels Kynureninase) katalysiert eine weitere Dioxygenase, die 3-Hydroxyanthranilat-3,4-Dioxygenase, die Spaltung des verbliebenen Aromatenrings, so dass nach mehreren Reaktionsschritten schließlich Acetacetat vorliegt. Der instabile Aldehyd, der nach Anwendung der zweiten Dioxygenase entsteht und sich spontan in Chinolinat umwandelt, wird teilweise bei der NAD-Biosynthese verwendet.
Mehrere der beim Abbau beteiligten Enzyme scheinen bei Ratten im Alter an Aktivität zu verlieren.[23]
Bei der Oxidation von Tryptophan oder Tryptophan-Einheiten von Proteinen durch Photooxidation oder Sauerstoffradikalen entstehen eine Vielzahl von Oxidationsprodukten, die bisher noch nicht alle identifiziert werden konnten.
Tryptophan und Immunsystem
Indolamin-2,3-Dioxygenase (IDO) ist ein Isoenzym der Tryptophan-2,3-Dioxygenase (Tryptophan Pyrrolase), das während einer Immunreaktion aktiviert wird, um die Verfügbarkeit von Tryptophan für z.B. Virus-infizierte Zellen oder Krebszellen und damit deren Wachstum einzuschränken. Aus diesem Grund werden im Blut von Patienten mit solchen Erkrankungen auch verminderte Tryptophanspiegel mit einer gleichzeitig gesteigerten Abbaurate beobachtet: je stärker die Tryptophanverminderung beim Patienten ausgeprägt ist, desto größer ist auch die Wahrscheinlichkeit einer kürzeren Überlebenszeit. Die verminderte Tryptophanverfügbarkeit ist aber auch mit ein Grund für eine gesteigerte Depressionsneigung bei diesen Patienten.[24]
Siehe auch
Literatur
- Berg/Tymoczko/Stryer: Biochemie, 5. Auflage, Spektrum Akademischer Verlag GmbH Heidelberg 2003, ISBN 3-8274-1303-6.
- Burger/Wachter: Hunnius Pharmazeutisches Wörterbuch Walter de Gruyter, 7. Auflage, Verlag 1993, ISBN 3-11-013868-9.
Handelsnamen
Ardeydorm (D), Ardeytropin (D), Kalma (A), sowie ein Generikum (D)
AKE (D), Alvesin (D), Aminofusin (D), Aminomel (D, A), Aminomix (D, A), Aminopäd (D, A), Aminoplasmal (D, A), Aminosteril (D), Aminoven (D), Clinimix (D, A), Custodiol (D, A), Deltamin (D), Glamin (D), Glavcamin (A), Infesol (D), Intrafusin (D), Kabiven (D), Nephrotect (D), Nutriflex (D, A), OliClinomed (D, A), Pädamin (A), Parentamin (D), Periplasmal (D, A), Salviamin (D), SmofKabiven (A), StructoKabiven (D, A), Synthamin (D), Vamin (A), Vitromix (A)
Einzelnachweise
- ↑ a b c d e Datenblatt Tryptophan bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c Tryptophan bei ChemIDplus.
- ↑ a b c d Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, S. 823.
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Auflage.
- ↑ V. R. Young, A. E. El-Khoury: Human amino acid requirements: A re-evaluation In: The United Nations University Press - Food and Nutrition Bulletin 17(3); Sept 1996 (Volltext).
- ↑ G. Lazaris-Brunner, M. Rafii, R. O. Ball, P. B. Pencharz: Tryptophan requirement in young adult women as determined by indicator amino acid oxidation with L-[13C]phenylalanine. In: Am. J. Clin. Nutr. 68(2); Aug 1998: S. 303-10 PMID 9701187 (freier Volltextzugriff).
- ↑ Radwanski ER, Last RL (1995), Tryptophan biosynthesis and metabolism: biochemical and molecular genetics. Plant Cell 7 (7): 921–34; PMID 7640526; PDF (freier Volltextzugriff).
- ↑ a b EC 4.2.1.20.
- ↑ M. Rössle, R. Herz, W. Hiss und W. Gerok: Der Tryptophan-Belastungstest als Funktionsparameter bei Lebererkrankungen. (PDF) In: Journal of Molecular Medicine; Springer Berlin / Heidelberg, Vol. 61, Nummer 6, März 1983, S. 277-283. doi:10.1007/BF01497776.
- ↑ Ledochowski M, Widner B, Fuchs D. Fructose malabsorption and the decrease of serum tryptophan concentration. Huether G Kochen W Simat TJ Steinhart H eds. Tryptophan, serotonin, and melatonin: basic aspects and applications 1999:73–78 Kluwer Academic/Plenum Publishers New York.
- ↑ a b L-Tryptophan – nature’s answer to Prozac by James South MA.
- ↑ EC 1.13.11.11
- ↑ Arzneimittelverschreibungsverordnung.
- ↑ Stoffliste der SwissMedic.
- ↑ Brian L. Williamson, Linda M. Benson, Andy J. Tomlinson, Arthur N. Mayeno, Gerald J. Gleich und Stephen Naylor: On-line HPLC-tandem mass spectrometry analysis of contaminants of l-tryptophan associated with the onset of the eosinophilia-myalgia syndrome, Toxicology Letters 92 (1997) 139−148, doi:10.1016/S0378-4274(97)00048-9.
- ↑ Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, Angewandte Chemie 90 (1978) 187-194; Angewandte Chemie International Edition in English 17, 176-183.
- ↑ Manfred Kircher und Wolfgang Leuchtenberger: Aminosäuren - ein Beitrag zur Welternährung, Biologie in unserer Zeit 28 (1998) 281-293.
- ↑ EC 1.14.16.4
- ↑ EC 4.1.1.28.
- ↑ 5-HTP: Doc Harris Presents Green Banana Award by Steven B. Harris, M.D.
- ↑ EC 1.14.13.9
- ↑ Comai S, Costa CV, Ragazzi E, Bertazzo A, Allegri G: The effect of age on the enzyme activities of tryptophan metabolism along the kynurenine pathway in rats. In: Clin. Chim. Acta. 360, Nr. 1-2, Oktober 2005, S. 67–80. doi:10.1016/j.cccn.2005.04.013. PMID 15970278..
- ↑ Widner B, Laich A, Sperner-Unterweger B, Ledochowski M, Fuchs D: Neopterin production, tryptophan degradation, and mental depression--what is the link?. In: Brain Behav. Immunity. 16, 2002, S. 590–595..
Weblinks
 Wikibooks: Biochemie und Pathobiochemie: Tryptophan-Stoffwechsel – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Tryptophan-Stoffwechsel – Lern- und Lehrmaterialien
Bitte den Hinweis zu Gesundheitsthemen beachten!  Proteinogene Aminosäuren
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Hydroxylysin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
tryptophan — tryptophan. См. триптофан. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
Tryptophan — Tryptophan, Abk. Trp, Proteinbaustein, aromatische, für den Menschen essentielle Aminosäure; Ausgangsverbindung für Niacin, Auxin, Indol 3 Essigsäure, Serotonin und Melatonin … Deutsch wörterbuch der biologie
tryptophan — (n.) also tryptophane, complex amino acid, 1890, coined in German from trypto , taken as a comb. form of TRYPTIC (Cf. tryptic) by trypsin, + Gk. phainein to appear (see PHANTASM (Cf. phantasm)). Trypsin (1876), the chief digestive enzyme of… … Etymology dictionary
tryptophan — [trip′tōfān΄trip′tə fan΄] n. [< TRYPT(IC) + O + PHAN(E)] a white, aromatic, crystalline, essential amino acid, C6H4NHCHCCH2CH(NH2)COOH, produced synthetically and in digestion by the action of trypsin on proteins: see AMINO ACID: also… … English World dictionary
Tryptophan — NatOrganicBox name=( S ) 2 Amino 3 (1H indol 3 yl) propionic acid PubChem = 6305 CAS = 73 22 3 SMILES = N [C@@H] (Cc1c2ccccc2n( [H] )c1)C(O)=O C=11 | H=12 | N=2 | O=2 mass=204.225 g/molTryptophan (abbreviated as Trp or W) [cite web | author=IUPAC … Wikipedia
tryptophan — /trip teuh fan /, n. Biochem. an essential amino acid, (C8H6N)CH2CH(NH2)COOH, colorless, crystalline, and aromatic, released from proteins by tryptic digestion and a precursor of serotonin. Abbr: Trp; Symbol: W Also, tryptophane /trip teuh fayn / … Universalium
tryptophan — 2 Amino 3 (3 indolyl)propionic acid; the l isomer is a component of proteins; a nutritionally essential amino acid. t. decarboxylase SYN: aromatic d amino acid decarboxylase. t. desmolase SYN: t. synthase. t. 2,3 dioxygenase an oxidoreductase… … Medical dictionary
Tryptophan — Tryp|to|phan 〈n. 11〉 eine essentielle Aminosäure * * * Tryp|to|phan [↑ Trypsin u. ↑ phan (2)], das; s, e; Symbol (für L T.): Trp, W; Syn.: α Amino 1H indol 3 propionsäure: farblose, bitter schmeckende krist. Verb., Smp. 292 °C. Die für den… … Universal-Lexikon
tryptophan — мед. триптофан (tryptophan) Аминокислота. Из нее вырабатывается серотонин. Способствует здоровому сну. Содержится в рыбе, говядине, индюшатине, твороге, яйцах, соевом белке, картофеле, бананах, чечевице, тыкве. Пища, богатая углеводами, и… … Универсальный дополнительный практический толковый словарь И. Мостицкого
tryptophan — triptofanas statusas T sritis chemija formulė NC₈H₆CH₂CH(NH₂)COOH santrumpa( os) Trp, W atitikmenys: angl. tryptophan rus. триптофан ryšiai: sinonimas – 2 amino 3 (3 indolil)propano rūgštis … Chemijos terminų aiškinamasis žodynas