- Iodstickstoff
-
Strukturformel 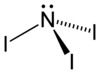
Allgemeines Name Iodstickstoff Andere Namen Stickstofftriiodid
Summenformel NI3 CAS-Nummer 13444-85-4 Kurzbeschreibung schwarzbrauner Feststoff[1]
Eigenschaften Molare Masse 394,7 g·mol−1 Aggregatzustand fest
Löslichkeit in Wasser Zersetzung[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Iodstickstoff (NI3), auch als Stickstofftriiodid oder chemisch korrekt mit Iodnitrid bezeichnet, ist eine äußerst labile chemische Verbindung von Iod und Stickstoff, die bereits bei geringster Energiezufuhr durch Reibung, Schlag oder Erschütterung eine stark exotherme Reaktion (Explosion) zeigt. Stickstofftriiodid gehört zur Stoffgruppe der Stickstoffhalogenide.
Aufgrund seiner Instabilität findet Iodstickstoff als Sprengstoff keine praktische Anwendung. Die Synthese von Kleinstmengen ist jedoch zur didaktischen Veranschaulichung im Rahmen des Chemieunterrichts interessant. Getrocknete Reste zerfallen nach kurzer Zeit mit einem spektakulären Knall, der von einer violetten Iod-Wolke begleitet wird.
Inhaltsverzeichnis
Synthese
In reiner Form wurde Iodstickstoff erstmals 1990 aus Bornitrid und Iodfluorid bei −30 °C in Trichlorfluormethan synthetisiert.[3]
Eher gebräuchlich ist die Darstellung durch Einleiten von Ioddampf oder Zugabe von Iodkristallen in eine konzentrierte Ammoniaklösung. Der Stickstoff wird analog zu den Kohlenwasserstoffen halogeniert. Dies führt zur Bildung eines meist als Iodstickstoff bezeichneten polymeren Stickstofftriiodid-Ammoniak-Adduktes, NI3·NH3. Dieses bildet schwarzbraune, rhombische Kristalle, die sich in Wasser zu Iodwasserstoff, Iod und Ammoniak zersetzen.
Das Produkt ist hochexplosiv und muss mit der nötigen Vorsicht behandelt werden.
Eigenschaften
Trockener Iodstickstoff zersetzt sich bei geringster mechanischer Einwirkung explosionsartig. Selbst die leichte Berührung mit einer Vogelfeder löst die Explosion aus. Auch spontane Explosionen kommen vor. Die Explosion erfolgt stets mit sehr scharfem Knall. Beim trockenen Feststoff ist größte Vorsicht geboten. Im Gegensatz zum getrockneten Feststoff kann man mit alkoholfeuchtem Iodstickstoff gefahrlos arbeiten, was diese Substanz in kleineren Mengen zu einem beliebten Chemikerstreich macht.
Ammoniak-Addukte
Je nach Temperatur und Lösungsmittel bildet Iodstickstoff mit Ammoniak den Hydraten entsprechende, verschieden gefärbte, polymere Addukte:[4]
- bei Temperaturen von −30 bis −15 °C fällt durch Zugabe von Iod in eine konzentrierte Ammoniaklösung ein schwarz-brauner Niederschlag der Zusammensetzung (NI3 · NH3)n aus;
- bei −35 bis −70 °C entsteht in flüssigem Ammoniak ein grünes, irisierendes, schlechtlösliches Polymer der Formel (NI3 · 3 NH3)n;
- bei −75 bis −95 °C bildet sich in einem 2:1-Gemisch aus Chloroform und Ammoniak ein roter Niederschlag eines Polymeren (NI3 · 5 NH3)n.
Die beiden letzteren Addukte können ineinander durch Variation der Temperatur umgewandelt werden. Alle Polymere bestehen aus Ketten von NI4-Tetraedern, die zusätzlich von Ammoniakmolekülen umgeben sind.
Weblinks
- Synthesevorschrift (PDF-Datei; 35 kB)
- Video mit einem Detonationsversuch
Einzelnachweise
- ↑ a b Helmut Sitzmann, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H.P. Latscha, H.A. Klein: Anorganische Chemie, 2002, S. 312ff, Springer, ISBN 3-540-42938-7
- ↑ J. Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compound, Pure & Appl. Chem., Vol. 49, pp. 67–73, Pergamon, 1977
Kategorien:- Iodverbindung
- Stickstoffverbindung
Wikimedia Foundation.



