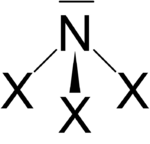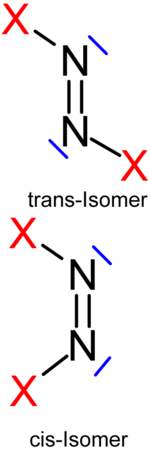- Stickstoffhalogenide
-
Stickstoffhalogenide sind binäre Verbindungen des Stickstoff mit Halogenen. Bei den meisten bisher bekannten Vertretern besitzen diese die Zusammensetzung NX3 (mit X = Halogen), es sind aber auch Halogenamine und Verbindungen mit zwei oder drei Stickstoffatomen pro Molekül bekannt.[1]
Inhaltsverzeichnis
Stickstofftrihalogenide NX3
Die Stickstofftrihalogenide besitzen analog zum Ammoniak (NH3) eine pyramidale Struktur mit 3 gleichwertigen Halogenatomen. Außer dem Stickstofftrifluorid sind diese Stickstoffhalogenide endotherme Verbindungen, die beim Erhitzen oder teils bei Berührung explodieren. Folgende pyramidalen Stickstofftrihalogenide sind bekannt[2]:
- Stickstofftrifluorid (NF3)
- Stickstofftrichlorid (NCl3)
- Stickstofftribromid (NBr3)
- Iodstickstoff (Stickstofftriiodid, NI3)
Aufsteigend mit dem beteiligten Halogen variieren auch die Stabilität, Farbe und Struktur der Stickstofftrihalogenide:
- das farblose Fluorid und das gelbe Chlorid bilden relativ stabile Einzelmoleküle, die sich erst beim Erhitzen zersetzen,
- das äußerst instabile, rote Bromid kann sowohl monomere, als auch polymere Modifikationen ausbilden,
- das hochexplosive Iodid schließlich liegt nur als schwarzes Polymer vor.[3]
Stickstoffwasserstoffhalogenide
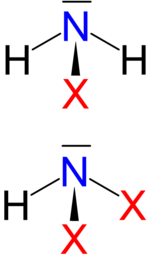
Neben binären Halogeniden wurden auch ebenfalls pyramidal gebaute Stickstoffwasserstoffhalogenide der Typen NHX2 und NH2X gefunden, die auch als Halogenamine bezeichnet werden.[1] Diese sind keine binären Verbindungen und im strengen Sinne keine Stickstoffhalogenide, werden aber von den meisten Lehrbüchern dennoch zu dieser Gruppe gezählt.[4] Dazu gehören:
Monohalogenamine NH2X
- Monofluoramin (NH2F)
- Monochloramin (NH2Cl)
- Monobromamin (NH2Br)
- Monoiodamin (NH2I)
Dihalogenamine NHX2
- Difluoramin (NHF2)
- Dichloramin (NHCl2)
- Dibromamin (NHBr2)
- Diiodamin (NHI2)
Höhere Stickstoffhalogenide
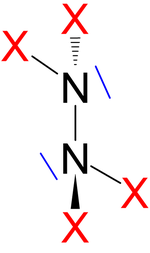
Neben den vom Ammoniak abgeleiteten, einfach-pyramidalen Stickstofftrihalogeniden und Halogenaminen existieren auch einige Verbindungen mit zwei oder drei Stickstoffatomen im Molekül. Die Distickstofftetrahalogenide N2X4 sind bipyramidal aufgebaut, ähnlich dem Ethan, wobei jedoch ein Wasserstoffatom durch ein freies Elektronenpaar ersetzt ist bzw. analog zu Hydrazin. Die Distickstoffdihalogenide N2X2 besitzen eine N=N-Doppelbindung und es treten cis-trans-Isomere auf.[1] Die Halogenazide N3X sind Derivate der Stickstoffwasserstoffsäure und besitzen deren Struktur. Die einzig stabile, nicht endotherme Verbindung ist das Distickstofftetrafluorid, alle anderen Verbindungen sind nur bei tiefen Temperaturen darstellbar und empfindlich auf Schlag und Temperaturerhöhung.
Distickstofftetrahalogenide N2X4
- Distickstofftetrafluorid (N2F4)
- Distickstofftetrachlorid (N2Cl4)
Distickstoffdihalogenide N2X2
- Distickstoffdifluorid (N2F2)
- Distickstoffdichlorid (N2Cl2)
Halogenazide N3X
- Fluorazid (N3F)
- Chlorazid (N3Cl)
- Bromazid (N3Br)
- Iodazid (N3I)
Übersicht wichtiger Eigenschaften
Eigenschaften der Stickstoffhalogenide[1] Stickstoffwasserstoffmonohalogenide Name Monofluoramin Monochloramin Monobromamin Monoiodamin Kurzbeschreibung farbloses Gas farbloses Gas rotviolette Substanz schwarze Substanz Entdeckung (Jahr, Person) 1988, Minkwitz 1923, Marckwand, Wille n.bek. 1962, Jander Smp./Sdp. (°C) ~ −100 °C (Zers.) / – ~ −70 °C, > −110 °C Zers. n.bek. > −90 °C Zers. ΔHf0 (kJ) (=Standardbildungsenthalpie) n.bek. 390 kJ n.bek. n.bek. Stickstoffwasserstoffdihalogenide Name Difluoramin Dichloramin Dibromamin Diiodamin Kurzbeschreibung farbloses Gas gelbes Gas orangefarbene Substanz schwarze Substanz Entdeckung (Jahr, Person) 1931, Ruff 1929, Chapin 1958, Jander 1962, Jander Smp./Sdp. (°C) −116,4 °C / −23,6 °C Zersetzung n.bek. > −60 °C Zers. ΔHf0 (kJ) −67 kJ n.bek. n.bek. n.bek. Stickstofftrihalogenide Name Stickstofftrifluorid Stickstofftrichlorid Stickstofftribromid Stickstofftriiodid Kurzbeschreibung farbloses Gas gelbes Öl tiefrote Kristalle tiefrote Substanz Entdeckung (Jahr, Person) 1928, Ruff 1811, Dulong 1975, Jander 1990, Klapötke Smp./Sdp. (°C) −206,8 °C / −129,0 °C −40 °C / 71 °C > −100 °C Explosion > −78 °C Zers. ΔHf0 (kJ) −125 kJ + 229 kJ n.bek. + 290 kJ Distickstofftetrahalogenide Name Distickstofftetrafluorid Distickstofftetrachlorid Distickstofftetrabromid Distickstofftetraiodid Kurzbeschreibung farbloses Gas n.bek. – – Entdeckung (Jahr, Person) 1957, Colburn n.bek. – – Smp./Sdp. (°C) −164,5 °C / −73 °C n.bek. – – ΔHf0 (kJ) n.bek. n.bek. – – Distickstoffdihalogenide Name Distickstoffdifluorid Distickstoffdichlorid Distickstoffdibromid Distickstoffdiiodid Kurzbeschreibung farbloses Gas n.bek. – – Entdeckung (Jahr, Person) 1942, Haller n.bek. – – Smp./Sdp. (°C) trans: −172 °C / −114,4 °C
cis: −195 °C / −105,7 °C
n.bek. – – ΔHf0 (kJ) trans: 82,1 kJ
cis: 69,5 kJ
n.bek. – – Tristickstoffmonohalogenide / Halogenazide Name Fluorazid Chlorazid Bromazid Iodazid Kurzbeschreibung grüngelbes Gas farbloses Gas orangerote Flüssigkeit farblose Substanz Entdeckung (Jahr, Person) 1942, Haller 1908, Raschig 1925, Spencer 1900, Hantzsch Smp./Sdp. (°C) −154 °C / −82 °C −100 °C / −15 °C −45 °C / Explosion ~20 °C / Explosion ΔHf0 (kJ) n.bek. + 390 kJ + 385 kJ n.bek. „n.bek.“ = Wert nicht bekannt, „–“ = Substanz nicht bekannt Einzelnachweise
- ↑ a b c d Vorlesungsscript, Universität Regensburg
- ↑ H.P. Latscha, H.A. Klein: Anorganische Chemie, 2002, Springer, ISBN 3-54042938-7, S. 312ff
- ↑ J. Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compounds. (PDF) Pure & Appl. Chem., Vol. 49, pp.67-73, Pergamon, 1977
- ↑ A.F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der anorganischen Chemie. Walter de Gruyter, 1995, ISBN 3-11012641-9
Kategorien:- Stoffgruppe
- Stickstoffverbindung
- Halogenverbindung
Wikimedia Foundation.