- Ionisierung
-
Ionisation heißt jeder Vorgang, bei dem aus einem Atom oder Molekül ein oder mehrere Elektronen entfernt werden, so dass das Atom oder Molekül als positiv geladenes Ion (Kation) zurückbleibt. Der umgekehrte Vorgang, bei dem ein Elektron von einem positiv geladenen Atom oder Molekül eingefangen wird, wird als Rekombination bezeichnet.
Eine weitere Form der Ionisation, die vor allem in der Chemie relevant ist, ist die Anlagerung von Elektronen an ein neutrales Atom oder Molekül, so dass ein negativ geladenes Ion (Anion) entsteht.
Ebenfalls kann Ionisation durch Anlagerung von Ionen (Protonen, Kationen, Anionen) erfolgen, z. B. in der Massenspektrometrie.
Wird der Kern eines Atoms aus der Elektronenhülle hinausgestoßen – z. B. durch ein schnelles Neutron – wird er dadurch ebenfalls zu einem Ion. Jedoch ist für diesen Vorgang die Bezeichnung Ionisation nicht üblich.
Inhaltsverzeichnis
Mechanismen der Ionisation
Zur Ionisation können verschiedene Prozesse führen:
- Ionisierende Strahlung (dazu zählen hier z. B. auch beschleunigte Elektronen in einer Thyratron-Röhre) kann durch Stoßionisation Elektronen aus ihrer Bindung „herausschlagen“. Die freigesetzten Elektronen können bei genügender Energie ihrerseits weiter ionisieren.
- Bei der Feldionisation werden Elektronen durch ein genügend starkes elektrisches Feld aus ihrer Bindung gelöst.
- Hoch angeregte Atome können durch Autoionisation selbstständig in einen ionisierten Zustand übergehen.
Symbolische Schreibweisen
Zur Beschreibung des Stoßionisationsprozesses werden häufig – analog der Schreibweise bei Kernreaktionen – Symbole wie (e,2e), (e,3e), (γ,2e) etc. benutzt. Hierbei steht das erste in der Klammer stehende Zeichen für das Projektil. Nach dem Komma stehen die produzierten freien Teilchen (zusätzlich zum ionisierten Atom und einschließlich des Projektils, sofern dieses nicht - wie im Falle des Photons - absorbiert wird). „2e“ bedeutet zum Beispiel, dass zwei freie Elektronen das Atom verlassen. Bei (e,2e) wird also durch Zusammenstoß eines Elektrons mit einem Atom ein einfach ionisiertes Atom erzeugt, bei (γ,2e) durch Wechselwirkung eines Photons mit einem Atom ein doppelt ionisiertes.
Ionisationsenergien
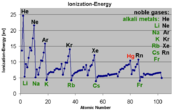
Für alle Ionisationsprozesse gilt, dass zur Trennung des Elektrons vom Atom oder Molekül Energie aufgebracht werden muss (Ionisationsenergie). Im vorangegangenen Abschnitt wurden mögliche Quellen für diese Energie genannt. Ionisationsenergien liegen typischerweise in der Größenordnung mehrerer Elektronenvolt (Beispiel Argon im Grundzustand: 15,7 eV). Ionisationsenergien sind abhängig vom zu ionisierenden Material und dessen aktuellem Anregungszustand. So wird es zunehmend schwieriger, bereits ionisierte Atome oder Moleküle weiter zu ionisieren.
Plasma
Ein Gas mit einem erheblichen Anteil Ionen und freien Elektronen bei insgesamt gleich großen positiven und negativen Ladungsmengen nennt man ein Plasma. Nahezu die gesamte sichtbare Materie im Universum ist mehr oder weniger stark ionisiert.
Anwendungsbeispiele
Mittels Ionisatoren ionisierte Luft wird bei Verarbeitung von Produkten verwendet. Die elektrostatische Aufladung wird abgebaut. Das beseitigt Gefahren, unerwünschte Partikel und erleichtert Transport.
Ionisierte Luft wird in der Lebensmittelindustrie eingesetzt, zum Beispiel bei der Pasteurisation von Bier und anderen Getränken. In der Getränkeabfüllung wird vor Füllbeginn die Flasche mit ionisierter Luft ausgeblasen, um Mikroorganismen abzutöten.
Ionisierende Strahlung wird bei industrieller Sterilisation (z. B. von medizinischen Einwegartikeln) benutzt.
Beim Ionenplattieren wird eine Oberfläche mittels Ionenbeschuss gereinigt und mit einem Metall beschichtet.
Typische Ionenkonzentrationen in Luft sind:
- Gebirge, Meer 5.000 Ionen/cm³
- Stadtrand, Wiesen, Felder 700-1.500 Ionen/cm³
- innerstädtische Parkanlagen 400-600 Ionen/cm³
- an Straßen (Bürgersteigen) 100-200 Ionen/cm³
- innerstädtische Wohnungen 40-50 Ionen/cm³
- geschlossene, klimatisierte Räume 0-25 Ionen/cm³
Ionisierter Luftsauerstoff findet u. a. in Meeresklimakabinen oder Solestollen Anwendung. Durch den osmotischen Effekt einer vernebelten Salzsole kann die ionisierte Luft besonders gut über die Atmungsorgane aufgenommen werden und die lebenswichtigen Organe mit dem im Blut angereicherten Sauerstoff versorgen.
Siehe auch
-
VON ZU Fest Flüssig Gasförmig Plasma Fest Phasentransformation Schmelzen Sublimieren - Flüssig Erstarren - Sieden/Verdampfen - Gas Resublimieren Kondensieren - Ionisation Plasma - - Rekombination -
Weblinks
Wikimedia Foundation.