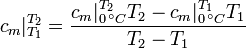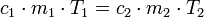- Joule pro Kilogramm und Kelvin
-
Die spezifische Wärmekapazität oder kurz spezifische Wärme eines Stoffes ist eine physikalische Eigenschaft und bezeichnet die auf die Masse bezogene Wärmekapazität.
dabei ist ΔQ die Wärme, die der Materie zugeführt oder entzogen wird,
m ist die Masse der Substanz,
c ist die spezifische Wärmekapazität (das meist verwendete c steht für engl. capacity = Kapazität)
und ΔT ist die Temperaturänderung.
Die Messung der spezifischen Wärmekapazität erfolgt über die Kalorimetrie.
Inhaltsverzeichnis
Einheit
Die spezifische Wärmekapazität gibt an, welche Wärmemenge einem Stoff pro Masseneinheit zugeführt werden muss, um seine Temperatur um ein Kelvin zu erhöhen. Daher ergibt sich die abgeleitete SI-Einheit der spezifischen Wärmekapazität wie folgt:
Verwendet werden aber meistens folgende Einheiten:
Spezifische Wärmekapazität von Gasen
Insbesondere bei Gasen hängt die Wärmekapazität von den äußeren Zwangsbedingungen ab. Man unterscheidet die spezifische Wärmekapazität bei konstantem Druck cp und bei konstantem Volumen cV.
Generell gilt
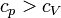
In erster Näherung gilt bei Gasen
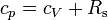 .
.
Hierbei ist Rs die spezifische Gaskonstante, mit Rs = R / M, wobei R allgemeine Gaskonstante und M die Molmasse ist.
Weiterhin gilt in guter Näherung
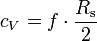 , wobei
, wobei 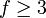 die Anzahl der energetischen Freiheitsgrade eines Moleküls angibt. Diese umfassen drei Freiheitsgrade kinetische Energie, Null bis drei Freiheitsgrade für die Rotationsenergie und Null bis n Freiheitsgrade für die innere Schwingungsenergie.
die Anzahl der energetischen Freiheitsgrade eines Moleküls angibt. Diese umfassen drei Freiheitsgrade kinetische Energie, Null bis drei Freiheitsgrade für die Rotationsenergie und Null bis n Freiheitsgrade für die innere Schwingungsenergie.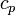 lässt sich auch aus
lässt sich auch aus 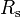 und dem Adiabatenexponenten κ berechnen:
und dem Adiabatenexponenten κ berechnen: 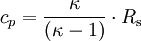
Dies folgt unmittelbar aus den oben genannten Gleichungen und
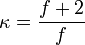 .
.Mittlere spezifische Wärmekapazität
Die mittlere spezifische Wärmekapazität wird für die Berechnung von Prozessen benötigt, bei denen die Temperaturabhängigkeit der Wärmekapazität von Bedeutung ist.
oder einfacher:
oder
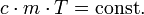 .
.
Die mittlere spezifische Wärmekapazität zwischen 0 °C und einer beliebigen Temperatur
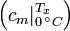 kann aus Tabellen abgelesen werden.
kann aus Tabellen abgelesen werden.Falls die spezifische Wärmekapazität der vorhandenen Temperaturen T1 und T2 in den Tabellen nicht aufgeführt sind, müssen die Wärmekapazitäten durch lineare Interpolation gefunden werden.
Es ist ausdrücklich darauf hinzuweisen, dass die Temperaturen in dieser Gleichung in Grad Celsius und nicht in Kelvin eingesetzt werden müssen, da es sich lediglich im Nenner der obigen Gleichung um eine Differenz handelt. Außerdem beziehen sich die Tabellenwerte ebenfalls auf Grad Celsius!
Literatur
- G. R. Stewart: Measurement of low-temperature specific heat. In: Rev. Sci. Instrum. Nr. 54, 1983, S. 1–11 doi:10.1063/1.1137207
- Michael Tausch: Chemie SII, Stoff - Formel - Umwelt. C.C. Buchners Verlag, Bamberg 1993, ISBN 978-3766164537
- Gustav Kortüm: Einführung in die chemische Thermodynamik. Verlag Chemie, Basel 1981, ISBN 3-527-25881-7 (bzw. Vandenhoeck & Ruprecht, Göttingen 1981, ISBN 3-525-42310-1)
- Walter J. Moore, Dieter O. Hummel: Physikalische Chemie. Verlag de Gruyter, Berlin/New York 1986, ISBN 3-11-010979-4
- David R. Lide: Handbook of Chemistry and Physics. 59. Ausgabe. CRC Press, Boca Raton 1978, ISBN 9780849304866, Seite D-210, D-211.
Weblinks
- Wasser und Energie bei Wissenschaft-Technik-Ethik.de - Berechnung: Gewinnbare Energie aus Wasserkraft und Energiebedarf für die Erwärmung von Wasser, Tabelle Wärmekapazitäten und Temperaturabhängigkeit
- Spezifische Wärmekapazität bei konstantem Druck cp
- Spezifische Wärmekapazität bei konstantem Volumen cV
Wikimedia Foundation.

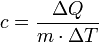
![[c] = \mathrm{\frac{J}{kg\cdot K}}](/pictures/dewiki/55/770e1b528287500cbe58b9b0735cfd6d.png)
![[c] = \mathrm{\frac{J}{g\cdot K}} = \mathrm{\frac{kJ}{kg\cdot K}} = 1000 \, \mathrm{\frac{J}{kg\cdot K}}](/pictures/dewiki/49/15f5304c2cfc5eeb82ebbab25bee5d41.png)