- Kathodischer Korrosionsschutz
-
Als Korrosionsschutz bezeichnet man Maßnahmen zur Vermeidung von Schäden, die durch Korrosion an metallischen Bauteilen hervorgerufen werden können. Da eine absolute Korrosionsbeständigkeit nicht hergestellt werden kann, zielen die ergriffenen Schutzmaßnahmen im allgemeinen darauf, die Geschwindigkeit des korrosiven Angriffs so weit zu verringern, dass eine Schädigung des Bauteils während seiner Lebensdauer vermieden wird.
Inhaltsverzeichnis
Korrosionsschäden
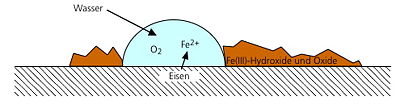
Kommt es durch einen Korrosionsangriff zu einer Beeinträchtigung der Funktionalität eines Bauteils, so spricht man von einem Korrosionsschaden. Der Begriff Korrosion wird heute nicht mehr nur für metallische Werkstoffe sondern auch für Glas, Kunststoffe, Baustoffe, etc. angewandt. Das angreifende Medium wird als korrosives Mittel bezeichnet. Nach DIN EN ISO 8044 werden u. a. folgende Korrosionsarten unterschieden:
- Flächenkorrosion, bei der die Oberfläche gleichmäßig beschädigt wird
- Muldenkorrosion, bei der die Oberfläche ungleichmäßig stark beschädigt wird
- Lochkorrosion, die nur kleine Bereiche der Oberfläche zerstört
- Spaltkorrosion, bei der die Werkstoffoberfläche in schmalen Spalten, z. B. in Schweißnähten, angegriffen wird
Um diesen chemischen Prozess zu verhindern, gibt es verschiedene Verfahren und Vorgehensweisen, die man allgemein als Korrosionsschutz bezeichnet. Im Folgenden wird auf den metallischen Korrosionsschutz näher eingegangen.
Man unterscheidet aktiven und passiven Korrosionsschutz. In Anlehnung an den Begriff „konstruktiver Holzschutz“ kann man ebenso auch bei metallischen Werkstoffen durch geeignete Konstruktion einen gewissen Korrosionsschutz erreichen.
Passiver Korrosionsschutz
Passiven Korrosionsschutz erreicht man durch einen geeigneten Überzug des Werkstoffes, um den Zugriff korrodierender Medien zu vermeiden. Beispiele sind Lack, Email, Gummi, oder eine Konversionsschicht, d. h. eine Phosphatierung, eine Eloxalschicht, eine Harteloxalschicht, eine Chromatierung oder andere Umwandlungsschichten mit eher nichtmetallischem Charakter.
Auch galvanotechnisch oder chemisch erzeugte, metallische Deckschichten aus Zinn, Gold, Nickel, Kupfer, Chrom oder Legierungsschichten wie Nickel-Phosphor (chemisch Nickel) bewirken einen Korrosionsschutz. Auch die Feuerverzinkung findet breite Anwendung. Ihre Schutzwirkung basiert bei Metallschichten auf ihrer Eigenschaft, selbst nicht zu korrodieren (Edelmetalle oder z. B. bei Nickel eine spontane Selbstpassivierung) oder aber auf Passivieren des Grundmetalles durch Bildung einer dichten Oxidsschicht auf der Oberfläche, die als Korrosionsschutz dient.
Einen gewissen Korrosionsschutz bietet auch Weißblech - hier wird Zinn als Beschichtungsmaterial verwendet, sodass auch Lebensmittel damit verpackt werden können. Allerdings entstehen nach einiger Zeit, wenn die Dose offen steht, Zinnionen, die toxisch auf z. B. Kresse wirken. Deshalb sollte die Dose zusätzlich lackiert sein.
Passiver Korrosionsschutz hat den Nachteil, dass die Schichten absolut dicht sein müssen - ansonsten findet an Poren unter Umständen verstärkte Korrosion statt (Lokalelemente).
Aktiver kathodischer Korrosionsschutz
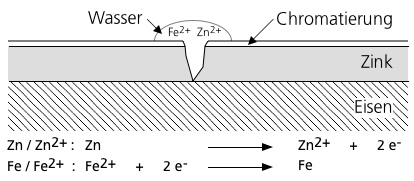
Unedlere Schichten schützen das Werkstück und fungieren dabei als Opfer- oder Schutzanode - die Schicht löst sich bevorzugt auf und erhält somit möglichst lang die Funktion des Bauteils. Ein klassisches Beispiel ist die Verzinkung von Stahl, aber auch der Schutz von Wasserbauwerken wie z. B. Schiffen, Schleusen, Spundwänden, Bootsteilen und Schienen durch entfernte Opferanoden aus Zink-, Aluminium- oder Magnesium-Legierungen.
Eine weitere Möglichkeit für den kathodischen Korrosionsschutz – kurz KKS – kann mittels Fremdstrom und Fremdstrom-Anoden erreicht werden. Bei Erdöl-Pipelines werden dazu z. B. in Abständen von einigen Kilometern in einigen hundert Metern Abstand von der Leitung Elektroden im Boden versenkt, die mit einer Gegenspannung gespeist werden. Der andere Pol liegt an der Pipeline, so dass dieses Spannungsgefälle genau das galvanische Element aus Boden und Metallleitung ausgleicht, was sich konkret in der Größenordnung von wenigen Volt bewegt. Da dies von der chemischen Zusammensetzung des Bodens abhängt, muss dieser untersucht werden und die eingespeiste Gegenspannung an die örtlichen Gegebenheiten angepasst werden.
Darüber hinaus werden Elektroden für den kathodischen Korrosionschutz aus titanummanteltem Kupfer (titanium clad copper) eingesetzt.
Eisen steht in der elektrochemischen Spannungsreihe positiver als Zink, d. h. Zink ist unedler als Eisen und stellt im galvanischen Element die Anode dar, und Eisen ist die Kathode. Eisen als edleres Metall ist daher so lange kathodisch geschützt, bis das Zink wegkorrodiert ist.
- Schutz eines Rohrleitungssystems durch Korrosionsinhibitoren, die in den Wasserkreislauf gegeben werden
- Zur Feststellung der Korrosionsfestigkeit von Beschichtungen werden genormte Umweltprüfungen durchgeführt. Hierbei werden z. B. Oberflächen mit Ritzprüfgeräten leicht verletzt, und dann einem Salzsprühnebel ausgesetzt.
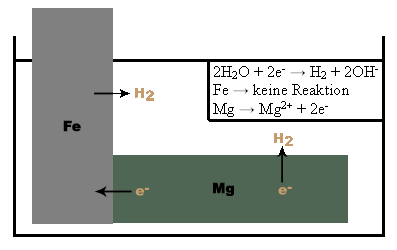
Mit dem aktiven Korrosionsschutz verfolgt man das Ziel, ein Metall, das oft in Berührung mit beispielsweise Wasser kommt, vor Rost zu schützen. Hierzu bedient man sich eines unedleren Stoffes, der quasi für das Metall geopfert wird. Die Reaktion läuft wie folgt ab: (am Beispiel Fe/Mg) Sobald Magnesium bzw. Eisen mit dem Wasser in Kontakt kommt wird es zu Mg2+ bzw. Fe2+ oxidiert. Diese Reaktion läuft nur sehr langsam ab, kann aber durch veränderte Bedingungen beschleunigt werden. Die auf das Wasser treffenden Elektronen spalten dieses nun in H2 und 2OH- auf. Das Eisen verändert sich nicht, da es auch die vom Magnesium abgegebenen Elektronen wieder aufnehmen kann. Das Magnesium hingegen löst sich nach einer bestimmten Zeit auf und der Rostschutz für das Eisen muss gegebenenfalls erneuert werden.
Versuch
Beispiel: Eisennagel
1. Ein ungeschützter Eisennagel wird in angesäuertes Salzwasser gegeben. Nach einiger Zeit geht das Eisen in Lösung und korrodiert, da keine Opferanode vorhanden ist. Des Weiteren bildet sich Wasserstoff (H2) am Eisennagel. 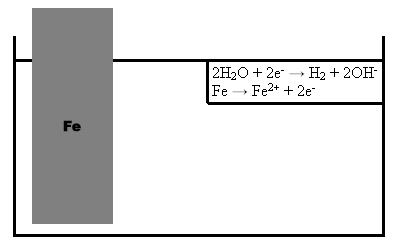 Abb. 1
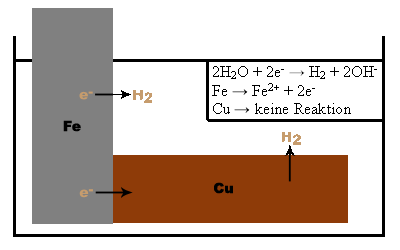
Abb. 12. Der Eisennagel wird mit dem unedleren Magnesium geschützt. Es kommt zur Bildung eines Lokalelements, indem Magnesium als Anode wirkt und sich somit für das Eisen opfert. Es bildet sich Wasserstoff. Zudem entsteht H2 an der Fe-Kathode. Der Grund hierfür ist im Elektronenfluss vom Mg zum Fe zu suchen, da Mg unedler ist als Eisen und somit ein größeres Reduktionsvermögen besitzt. 3. Beim Gegenversuch mit dem edleren Kupfer wirkt das Eisen als Anode und das Kupfer kann das Eisen nicht vor der Korrosion schützen. Auffallend ist, dass das Eisen dadurch schneller oxidiert wird. Auch hierbei findet ein Elektronenfluss statt, der jedoch vom Fe zum Cu verläuft. Damit wird die Korrosion beschleunigt. Beim Korrosionsschutz mittels Opferanode werden je nach Anwendung Anoden aus unterschiedlichen Werkstoffen verwendet. Die Opferanode muss mit dem zu schützenden Metall leitfähig verbunden sein, um einen Schutz zu erreichen.
Siehe auch
Literatur
Ulrich Bette, W. Vesper: Taschenbuch für den Kathodischen Korrosionsschutz. Vulkan, 2005, 7. Auflage, 367 Seiten, ISBN 978-3-8027-2932-4.
Links zum Thema
Überblick zum Thema kathodischer Korrosionschutz durch titanummanteltes Kupfer
Wikimedia Foundation.